はじめに
慢性閉塞性肺疾患(COPD)は、現代社会全体の死亡率および罹患率の大きな原因である。 COPDは強制呼気1秒量(FEV1)だけでは定義できないため、Global Initiative for Chronic Obstructive lung Disease(GOLD)はCOPDを評価する多次元的定義を考案しました2。 症状の評価には、modified Medical Research Council(mMRC)またはCOPD Assessment Test(CAT)のいずれかが推奨されます。 さらに、日常生活への影響を評価するために、疾患特異的なQOL尺度(SGRQ、SF-36、CCQ)が使用されています。 CATとSt. George’s Respiratory Questionnaire(SGRQ)の間に強い関係があることを示した研究もある3,4。Ladeiraら5 は、CATとBODE指数の相関を示した。
COPD は複雑な疾患で、遺伝子、細胞、分子の要素を含んでいます。 炎症経路には多くの異なる細胞や分子が関与している。 気道や肺実質の炎症はCOPDの主要な発症機序であり、疾患に関連した全身性の炎症の可能性を示すためにいくつかの指標が用いられている。 さらに、持続的な全身性炎症は、様々な肺外併発症や肺への影響と関連している可能性があります。10 最近の研究により、「新規全身性炎症性COPD表現型」という明確な表現型の存在が証明されました。 7 最近の研究では、心血管疾患や糖尿病が全身性炎症マーカーの高値と関連していることが示されています。11 したがって、遺伝的負荷、全身性炎症、合併症がCOPDの様々な表現型と関連しています。 現在、COPDの評価やモニタリングにCATが用いられることが多くなっている。 COPDではいくつかの血清バイオマーカーが定義されているが、COPD患者の状態を評価するのに十分かつ有効な単一のバイオマーカーは存在しない。 バイオマーカーは、炎症、入院、死亡率などいくつかのパラメータと関連することが示されている7-13。しかし、CATとバイオマーカーの関係は明確に示されていない。 そこで本研究では、COPDにおける全身性炎症のレベルを調査し、CATと炎症マーカーおよびQOLとの関係を明らかにすることを目的とした。 2013年2月から2013年8月にかけて、GOLD基準14に従って診断されたCOPD患者110名と対照者65名を募集した。 対照対象者は、Balikesir大学病院の呼吸器科と内科のクリニックに紹介され、日常的な検査を受けている人から選ばれた。 全参加者から書面によるインフォームドコンセントを取得し、本研究はBalikesir大学医学部の施設倫理委員会によって承認された。
全患者に身体検査、胸部X線、呼吸機能検査、ルーチン血液分析検査が実施された。 前年の増悪回数と喫煙歴が記録された。 呼吸器専門医によるCAT,mMRC dyspnea scoreの対面面接が行われた。 SGRQスコアは患者から報告された。 健常対照群では呼吸機能検査とルーチンの血液分析検査のみが行われた
研究の対象
包含基準。 1)40歳以上、(2)喫煙歴10箱年以上の現在または過去の喫煙者、(3)気管支拡張後のFEV1
80%およびFEV1/FVC0.7を示した患者を対象とした。 対照者は以下の条件を満たす者を対象とした。 (1)40歳以上、(2)医師の診断により肺疾患がない、(3)スパイロメーターが正常(FEV1>85%、FEV1/FVC>0.7)、(4)喫煙歴が
である者を除外基準。 (1)過去6週間以内にCOPDの増悪があった患者、(2)COPDまたは悪性腫瘍以外の呼吸器疾患を有する患者、(3)慢性炎症性疾患(血管炎、炎症性腸疾患、関節リウマチなど)を有する患者は除外とした。(4)コントロールされていない、あるいは重度の併発疾患(MI、不整脈など)があった。
測定
人口動態、年齢、性別、喫煙習慣、過去1年間の救急病院への入院、併発疾患、既存の治療などはすべて適切に記録されていた。 増悪の定義は,経口副腎皮質ホルモン剤および/または抗生物質および/または入院を必要とする症状の悪化とした。 併存疾患は病歴と診察所見から判断し、医療記録を確認した。 吸入器、降圧剤、その他の薬剤を含む現在の薬剤が記録された。 身長、体重、BMI 指数を測定し、国際ガイドライン(ATS/ERS)に従ってスパイロメトリーも実施した15。疾患は、新旧バージョンの GOLD 病期分類14に従って分類した。第1に、GOLD スパイロメトリー病期(FEV1 ベース(1-4)病期)、第2に GOLD 病期(A-D クラス)であった。 呼吸困難はmMRC呼吸困難スケールで評価した16。COPD患者はmMRC呼吸困難スコアによる症状評価と増悪リスクを組み合わせてA、B、C、Dに分類した<7209><9514>CAT.CAT.CAT.CAT.CAT.CAT.CAT.CAT.CAT.CAT.CAT.CAT.CAT.CAT: CATは8項目からなり、0点から40点までの合計点が得られる。高得点は、健康状態の障害がより深刻であるか、COPDのコントロールがうまくいっていないことを示す3
生活の質(Quality of Life Questionnaire)。 QOLはSt. George’s Respiratory Diseases Questionnaire(SGRQ)のトルコ語訳を使用して評価した18
バイオマーカー
バイオマーカーは過去の研究に基づいて選択した7、9-13。すべての被験者から採取した血液サンプルは遠心分離して-80℃で保存された。 すべてのサンプルは試験終了後に分析された。 血清は診断装置(BioTek, ELx 800, USA)で市販のキット(eBioscience, Human TNF-α and Human IL-6 Platinum ELISA, Austria)を使用し、腫瘍壊死α(TNF-α)およびインターロイキン6(IL-6)レベルの酵素結合免疫吸着測定法(ELISA)で調査された。 C反応性蛋白(CRP)は,臨床化学分析装置(Cobes Integra 800, Roche diagnostics)を用い,市販のキットを用いて評価した. CRPの基準値は0〜0.5mg/Lであり,IL-6の分析下限値は0.92pg/mlであった. TNFαの分析下限値は2.3pg/mlであった。 TNF-αとIL-6の濃度が定量下限値(LLQ)を下回る検体もあった。 19
統計解析
類似研究よりCOPD群と対照群のCRP平均値(3.2 (1.5,7.1), 1.3 (0.6,2.7) )を求め、各群において平均算出式により80%の精度、5%の誤差でサンプルサイズを算出したところ、COPD群では1.5%、対照群では2.5%であった。 その結果、サンプルサイズは各群 55 名以上であることが判明した。 結果は、適宜、平均値±SD、中央値、または百分率で表示した。 パラメトリック検定にはStudentのt-testとANOVAを、群間比較のノンパラメトリック検定にはMann-Whitney U-test、Kruskal-Wallis、カイ二乗統計学を使用した。 Fisherの正確検定では,合併症の割合の差と男女間の差を評価した. カイ二乗検定では、合併症の割合の差を評価した。 COPD患者における連続変数の一対相関は、Pearson相関で調べた。 p
0.05の値を統計的に有意であるとみなした。 すべての統計解析はSPSS(バージョン20.0)ソフトウェアで行った。結果被験者の臨床的特徴
本研究には110名の患者(平均年齢64±8.9歳、男性100名(90.9%))と65名の対照被験者(平均年齢61.5±9.2歳、男性55名(84.6%))が参加した。 患者群と対照群の人口統計学的および臨床的特徴を表1に示す。 COPD患者45名(40.9%)は、付随する疾患(虚血性心疾患(n=21)、高血圧症(n=13)、糖尿病(n=8)、その他(n=3))を有していた。 COPD群では,平均FEV1:予測値の48.8%,平均FEV1/FVC:55.4%であった. CATスコアの平均は22.6(±9.2),mMRC:1.9(±0.9),Total SGRQ:58.4(±22.2 )であった。 110名の患者のうち,GOLD spirometric stagingによると,ステージ1が9.1%,ステージ2が37.3%,ステージ3が42.7%,ステージ4が10.9%であった。 GOLDステージングに関して患者を分類すると、27.3%がA群、30.9%がB群、7.3%がC群、34.5%がD群だった。
患者群と対照群の人口統計、機能、臨床的特徴。
| Patient (n=110) | Control (n=65) | p値 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Age | 61.5±9.2 | 0.080 | ||||||||
| Male n, (%) | 100 (90.9) | 55 (84.9)6) | 0.224 | |||||||
| BMI, kg/m2 | 26.5±5.6 | 25±2.6 | 0.224 | |||||||
| 0.064 | ||||||||||
| パックイヤー | 38.9±23 | 0.1±1.2 | ||||||||
| 共傷病、n (%) | ||||||||||
| いずれも | 65 (59.0 %)1) | 42(64.6) | 0.95 | |||||||
| 虚血性心疾患 | 21(19.1) | 11(16.9) | HT | 13(11.1) | ||||||
| 10(11.0) | ||||||||||
| 10(11.0) | 10(11.8) | 6 (9.2) | ||||||||
| DM | 8 (7.3) | 4 (6.2) | ||||||||
| その他 | 3 (2.0) | 2 (3.1) | mMRC | 1.94±0.9 | 0.04±0.2 | |||||
| FEV1, % predicted | 48.8±17.0.8 | 89.4±5.6 | ||||||||
| FVC, % predicted | 68.7±17.8 | 92.1±5.8 | FEV1/FVC, % | 55.9±17.9 | 予測された % FVC, % 予測の % | の | の | 89.6±4.7 | ||
| 1 | 10 (9.0).1) | |||||||||
| 2 | 41 (37.3) | |||||||||
| 3 | 47 (42.7) | |||||||||
| 4 | 12 (10.9) | A | 30(27.3) | |||||||
| B | 34 (30.9) | |||||||||
| c | 8(7.3) | |||||||||
| d | 38(34.1) | 8(3.15) | SGRQ-トータルスコア | 58.4±22.2 | CATスコア | 22.6±9.2 | TNFα (pg/ml) | 109.5±58 | 14.6±18 | |
| IL-6 (pg/ml) | 10.6±10.2 | 10.3±18 | 2.14±1.9 | |||||||
| CRP (mg/L) | 1.6±1.7 | 0.4±0.3 | ||||||||
COPD/対照比較
両群の年齢(p=0.080、スチューデントt検定)、性別(p=0.453、フィッシャー正確検定)に有意差はなかった(表1)。 両群の併存疾患の発生率はほぼ同じであった(p=0.095, χ2検定)。 予想通り,COPD患者は対照群と比較して肺機能パラメータ(FEV1,FVC,FEV1/FVC)が有意に低かった(p
0.001,Student’s t-test). 一般に,COPD患者は健常対照者と比較して,CRP(1.6±1.7mg/L),TNF-α(109.5±58pg/ml)およびIL-6(10.3±18pg/ml)の高い血清レベルを示した(CRP: 0.4±0.3mg/L, p0.001; TNF-α: 表1)。CAT問診票と患者特性の関連性
CATスコアとGOLDスパイロメーターステージの間に相関があった(Pearson’s r=0.43; p
0.001 )。 CATスコアは,疾患の重症度と並行して上昇した。 CATスコアと前年度の増悪回数(Pearson’s r=0.35, p0.001),疾患期間(Pearson’s r=0.29, p0.001),喫煙(パックイヤー)(Pearson’s r=0.27, p=0.014),mMRC(Pearson’s r=0.59, p0.001)間には統計的有意差があった. CATスコアは,FEV1(ピアソンのr=-0.39,p0.001)およびFVC(ピアソンのr=-42,p0.003)と有意な相関があることが判明した. 同時に,CATスコアとSGRQの症状,活動性,影響,総合スコアの間に強い相関が認められた(Pearsonのr=0.72,p0.001)バイオマーカーと患者特性の関連
炎症マーカーと肺機能パラメータを比較した. FEV1が低下するにつれて,バイオマーカーの値は有意に上昇した。 CRPはFEV1(Pearson’s r=0.39、p
0.001)、FVC(Pearson’s r=0.33、p0.001)、FEV1/FVC(Pearson’s r=0.38、p0.001)に相関がみられた。 TNF-αレベルもFEV1(ピアソンのr=0.57、p0.001)、FVC(ピアソンのr=0.37、p0.001)、FEV1/FVC(ピアソンのr=0.66、p0.001)と相関があった。 IL-6値はFEV1(ピアソンのr=-0.31、p0.001)、FVC(ピアソンのr=-0.32、p0.001)、FEV1/FVC(ピアソンのr=0.34、p0.001)にも相関があった。 CRP、TNF-α、IL-6と喫煙(パックイヤー)の間に有意な相関が認められた(それぞれPearson’s r=0.35, r=0.44, r=0.27, p0.001)。 心血管疾患を有するCOPD患者では、CRPの値が上昇した(2.98±2.4mg/L)を、合併症のない患者(1.56±1.5mg/L、p=0.008 ANOVAテストとLSDポストホックテスト)と比較した。 他のバイオマーカーや併存疾患との有意な関連は認められなかった。 IL-6が増加すると、mMRCスコアが増加したが、この関係は統計的に有意ではなかった(p=0.06)。 炎症マーカーをCATスコアと比較すると、CRP値は有意な相関を示したが(r=0.43、p0.001)(図1)、TNF-αおよびIL-6との相関は認められなかった。 CRP値とTNFαには相関があった(r=0.48, p0.001)。 バイオマーカーとA-Dクラスやスパイロメトリックステージとの直接的な関連は認められなかった。
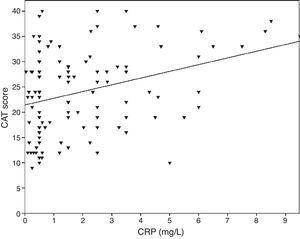
CATスコアとCRPの関係(r=0.43、p0.001).
Discussion
COPDの評価には臨床検査(CAT、BODE)、炎症マーカー、QOLアンケートなどいくつかの評価ツールを使用することがある。 疾患を理解し管理するためには多面的な評価が必要であることは一般的に受け入れられている。 COPDは全身的な要素を持つ複雑な疾患であり、一部の患者は炎症性表現型を有すると思われる。 本研究では,新たな臨床検査としてCATを実施し,他のCOPD構成要素との関連性を検討した
これらの構成要素の一つに全身性炎症が挙げられる. COPDで最もよく研究されている全身性炎症を示すバイオマーカーは、一般的にCRP、IL-6、TNF-α、IL-8、フィブリノーゲンである。 最近の研究では、Agustíらは、COPD患者の30%は全身性炎症の所見を示さず、16%は持続的な全身性炎症を呈していると報告しています。 また、白血球、IL-6、CRP、フィブリノーゲンなどのマーカーは、COPD患者において、喫煙者、非喫煙者に比べて高いことがわかった。 本研究では、CRP、TNF-α、IL-6の値は、対照群と比較して、すべてのCOPD患者で有意に高値であった。 すべてのバイオマーカーは、累積喫煙量および肺機能検査パラメータ(FEV1、FVC、FEV1/FVC)の低下と相関することが明らかにされた。 バイオマーカーレベルは、気流閉塞の程度に関連している。 ECLIPSEの結果を検討した別の研究では、心血管疾患と糖尿病がいくつかの全身性炎症マーカーと相関していました。9 今回の研究では、心血管疾患を有するCOPD患者は、合併症のない患者と比較してCRPのレベルが上昇していました。 COPDと心血管系疾患の合併は、COPDと心血管系疾患の病態生理学的な関係を示唆するものである。 ある研究では、LCN1、LCN2、CATの間に有意な相関があることが示された8。 しかし、TNF-αやIL-6との間には同様の相関を示すことができなかった。
本研究では、COPD患者を新旧のGOLD分類に従って4群(A-D)、ステージ(1-4)に分類した。 旧分類ではステージ1とステージ4がそれぞれ10%と最も少ない割合であったのに対し、新分類ではステージ3とステージ4がそれぞれ10%と最も少ない割合であった。 新分類では、A、B、D群にほぼ均等に分布し、最も分布が小さいのはC群である。24,25 他の研究でも、C群が最も少ない割合を占めることが示されている。新分類では、複数の症状があっても気道閉塞が軽い患者と、症状が少なくても重度の気道閉塞がある患者がいる可能性があることが示されている。 併存疾患や全身性の炎症は、軽度・中等度の閉塞を有する患者さんの増悪や症状の悪化を招き、このような患者さんを高リスク群(CまたはDクラス)に位置付けることになります。 ある研究では、Cサブタイプには合併症状態の高い患者が含まれ、Dサブタイプには最も重度の増悪、入院に関連する増悪の割合が高く、転帰が最も悪い患者が含まれることが示されている26。 最近の研究では、Agustíらは、持続的な全身性炎症のある群とない群の2群を比較し、肺の異常はこれら2群で同様であったが、追跡調査中に持続的な炎症を示す患者は、他の群に比べて年間増悪率が高いことを示した7
GOLD は、症状の評価にCATまたはmMRCスケールを使用することを推奨している。 CATをもとに症状を検討したところ,ブレイクポイントが10未満の患者が8名と非常に少なかったため,mMRCスケールを用いて群分けを行った。 CATのスコアが高いほど,患者の症状に対する認識が高いことが考えられる。 また、CAT と mMRC は同等ではないことが示されており、このことが分類の違いを生んでいる可能性がある。24,25,27 新しい分類では、その他のカットオフポイントは、年間増悪回数で構成されている。 Pothirat らは、モニタリング受診時の CAT スコアの変化が COPD 患者の健康状態の急 激な悪化を検出する有用なツールであることを示している29。 また、CATは罹病期間や喫煙(パックイヤー)とも相関が認められた。 患者の平均 FEV1 は予測値の 48.8%であり,平均 CAT スコアは 22.6 であった. CATとFEV1,FVC,GOLDスパイロメトリックステージとの間に強い相関が認められた. FEV1およびFVCが低下すると,CATスコアは上昇した. また、CATスコアはGOLDステージが重いほど正の相関を示した。 これらの結果は、CATが重症度を非常によく反映していることを示している。
COPD管理におけるもう一つの重要な要素は、QOL(生活の質)である。 日常生活への影響を評価するために、様々な生活質問票が使用されてきた。 30いくつかの研究では、CATとSGRQの間に有意な相関が観察されたことが示されている3,4。ある研究では、CATはCOPD増悪に伴う健康状態の変化に敏感であると報告されている31。 CATはSGRQと比較して、検査時間が短く、理解しやすいため、CATの使用はより実用的である。
本研究は、横断的デザイン、単一施設研究、サンプルサイズが小さいなど、いくつかの制限がある。 また、肺機能が正常な喫煙者は本研究に含まれていないため、炎症マーカーの比較はできなかった。 また、患者への投薬が全身の炎症反応や健康状態に影響を及ぼし、結果に影響を与える可能性もある。
以上のことから、CATは信頼性と妥当性が明確に示されており、COPDの評価に用いることができる検査であると考えられる。 本研究の結果は、CATとCRPだけでなく、他のCOPD構成要素(臨床、機能パラメータ)との関係も示している。 しかし,CATとバイオマーカーの関係を評価するためには,縦断的な多施設共同研究が必要である。
倫理的開示ヒトおよび動物被験者の保護
著者らは,この研究のためにヒトまたは動物に対する実験が行われていないことを宣言する。
Confidentiality of data
著者らは、患者データの公開に関する勤務先のプロトコルに従ったこと、本研究に参加したすべての患者が十分な情報を受け取り、研究への参加に書面で同意したことを宣言する。
Right to Privacy and informed consent
著者らは、論文で言及した患者または対象者から書面でインフォームドコンセントを得ている。 対応する著者はこの文書を所持している。
著者名
研究デザイン。 NS、FE、AAH;データ収集。 NS、CB;データの解析と解釈。 NS、AAH、CB;原稿の重要な改訂。
利益相反
著者らは、本原稿の作成において利益相反がないことを宣言する
。
