はじめに
低カリウム血症は内分泌学者や腎臓内科医の診療においてよく見られる臨床上の問題である. 低カリウム血症の原因としては、下痢や嘔吐、利尿剤の乱用など、明らかなものが多くあります。 しかし、尿細管障害のような他の原因はほとんど観察されず、その診断はより困難である。 1
低カリウム血症の原因として比較的よく知られているが見落とされているものに、ギテルマン症候群(GS)2がある。 SLC12A3遺伝子は、チアジド感受性トランスポーターNCCT(塩化ナトリウム共輸送体)をコードしています。 NCCTは遠位尿細管細胞(DCC)に存在し、電解質の尿細管吸収の7~10%を担っている3
GSで認められる最も重篤な臨床検査値異常は、腎のK+およびMg2+の消耗による低カリウム血症と低マグネシウム血症である。 4 軽度から中等度の低リン酸血症がしばしば観察される。5 重度の低ナトリウム血症を伴う重度の低リン酸血症も報告されている6,7。
糖化症の初発症状は、成長が正常で、塩分を欲する行動(ピクルスや塩水、塩漬けキュウリ、オレンジ、レモンなどを好んで食べる子供、ポテトチップスの塩をなめる子供など)が見られる子供や若年層でみられます8。 無症状の患者もいれば、生命を脅かすような合併症を起こす患者もいます。 8 最も一般的な症状は、筋肉のけいれんや脱力、便秘、夜間頻尿、口渇、多飲、不整脈、知覚異常、食塩摂取量の増加です。 しかし、高齢者では高血圧を生じることがあります。9 生化学的異常と症状の相関は強くありません。 11 極度の疲労感、筋力低下、知覚異常、重度の疲労、低血圧は、軽度から重度の日常生活動作の低下を伴う。9
ヨーロッパにおけるGSの推定有病率は1:40,0008、ヘテロ接合体の有病率は少なくとも1%と言われています。 12
症例報告
26歳男性が失神、全身および筋力低下、筋痙攣の発症のため入院した。 既往歴に失神のエピソードがあり,カリウム値は3.16mmol/lであった. 外来での経過観察では、低カリウム血症の再発が認められた(最低値2.6mmol/l)。 血圧は110/80、心拍数は72/分と正常であり、身体所見に変化はなかった。 神経学的所見もなく、体重74kg、身長178cm。 入院時の検査では、軽度の低カリウム血症(K+ 3.0mmol/l)、低マグネシウム血症(Mg2+ 1.36mg/dl )、低カルシウム尿症(
mg/24h)、代謝性アルカローシス(HCO3- 29.7mmol/l, BE 5.3mmol/l )がみられた。 腎機能はeGFR>60ml/minと良好であった。 画像検査は異常なく、心電図も異常なかった。
さらなる検査で、低カリウム血症は腎臓のカリウム消耗が原因であることが確認された。 24時間カリウム消耗、経管K+グラディエント(TTKG)、分数K+排泄(FeK)、ランダムK/クレアチニン比(K/Cr)は高カリ尿症に典型的で、表1に示す通りであった。13-15日マグネシウム尿は64mg/24hで、分画マグネシウム(FeMg)排泄量は15%でした。
低カリウム血症の診断値.13-15
| 不適切なカリウム尿の診断値 | ||
|---|---|---|
| 尿K+ | >20mmol/24h If serum K+3.K+3.5mmol/l |
57mmol/l (serum K+=3.0mmol/l) |
| FeK=×100% | >6.5% If 血清K+3.5mmol/l |
12% (serum K+=3.0mmol/l) |
| TTKG= | TTKG>2 If 血清 K+3.5mmol/l |
7.3 (serum K+=3.0mmol/l) |
| uK/Cr – ランダム尿K+/クレアチニン比 | uK/Cr>15mmol/g If serum K+3.5mmol/l |
67mmol/g (serum K+=3.0mmol/l) |
血圧は正常であったが、コン病除外のためのホルモン検査と腹部CTを行ったが、副腎に異常は認められなかった。 アルドステロン289pg/ml(正常範囲20-180),レニン205mIU/ml(正常範囲2.8-39.9)の二次性高アルドステロン症はGSの典型例であった。
臨床表現型をもとにGSと診断された。 診断後,カリウムとマグネシウムの補給による治療が導入された。 塩化カリウム20mmolとピロリドンカルボン酸マグネシウム18mmolを投与し,臨床的改善をみた。 家族歴では、患者の35歳の姉に軽度の無症候性低カリウム血症が認められた。 しかし、検査では高カリウム血症も低マグネシウム血症も認められなかった。 遺伝学的解析
野津の提唱する遺伝学的解析アルゴリズムによると、低カリウム血症の代謝性アルカローシス患者で、満期産、正常体重、ネフロカルシノーシスなし、低カルシウム尿症、低マグネシウム血症の患者にはSLC12A3遺伝子を検査すべきとされている
この症例では遺伝子検査を行い2つのヘテロ接合変異:c.3536insAとc.1095+5G>Aの2つのヘテロ接合型変異がSLC12A3遺伝子のNM_000339.2転写産物に認められた(図1)。 両変異ともHGMD(r)データベースには未登録である。 最初の変異は患者の母親にも、2番目の変異は父親にも見られた。
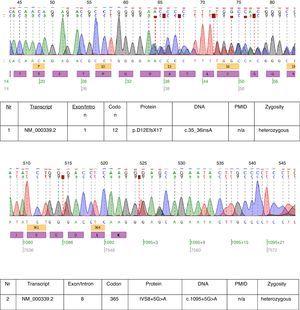
Chromatograms of affected patient’s DNA sequencing.
この患者で見つかった変異はほぼGSの臨床診断を証明するものであった。 フレームシフト変異の病因的な関連性は明らかである。 しかし,イントロン8のスプライスサイトの変異については,病因的な関連性は不明である。 イントロン8のスプライスドナーのコンセンサス配列G (100%), T (100%), A (62%), A (68%), G (82%), T (63%)はコンセンサスGTgAGcと正確に一致しない。 この患者で見つかった変異は、さらにコンセンサス(GtgAac)から配列がずれている。 また、Mutation Tasterによるin silico解析では、この変異は疾患を引き起こすと考えられている17
Discussion
Tubulopathiesは稀な疾患である。 RenalTubeのデータベース18によると、ヨーロッパ人に最も多い原発性尿細管症は遠位尿細管性アシドーシス、バーター症候群、高カルシウム尿症を伴う家族性低マグネシウム血症、そしてGSである18。 本症例は典型的な腎症候を呈し、治療効果も良好であった。 しかし、低カリウム血症を見落とすと、心停止や呼吸筋麻痺による死亡に至ることがある。 遺伝性尿細管症は,利尿剤による後天性尿細管症という “鏡像 “をもっている。 すべての利尿剤(正確にはナトリウム利尿剤,アクアレチックス,グルクレチックス)は,遺伝性尿細管症に見られるような異常を引き起こす(表2)。 ほとんどすべての尿細管症で多尿が起こり、カリウム濃度の変化が最も一般的な問題の一つである。 GSの患者さんではSLC12A3遺伝子の変異が見つかっている。 この遺伝子はチアジド感受性のトランスポーターをコードしている。
利尿剤と尿細管症.
| 遺伝性単一遺伝子異常 | カリウム濃度 | 使用に類似する症状。 | 遺伝子 | 遺伝子産物の位置 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Guibaud->Vainsel症候群(RTA 3) | ↓ | Acetazolamide | CA2 | CA II | Proximal Tubule(近位尿細管 | ||||||
| 腎性糖尿 | – | SGLT2 inhibitorsa (Canagliflozin, トホグリフロジン Dapagliflozin) | SLC5A2 | Sodium/glucose cotransporter 2 (SGLT2) | 近位尿細管 | ||||||
| Bartter syndrome | ↓ | Furosemide | SLC12A1b | Na->SLC12A1bK-2Clコトランスポーター(NKCC2) | Loop of Henle | ||||||
| Gitelman症候群 | ↓ | Thiazide | SLC12A3 | Thiazide- SLC13 | Chiazide- | ChiazidNa-Cl感受性共輸送体 | 遠位尿細管 | ||||
| 糖尿病性消耗症 | – | ヴァプタン | AVPR2, AQP2 | V2受容体 | 集合管 | ||||||
| Pseudohypoaldosteronizm.LLC | V2受容体 | V2受容体 | 集積管(AQP2) | ||||||||
| ← | スピロノラクトン | NR3C2 | スピロノラクトン感受性ミネラルコルチコイド受容体 | 集合管 | |||||||
| Pseudohypoaldosteronizm.B | Spironolaktone-sensitive mineralocorticoid receptor | Spinson | NR3C2 AR | アミロライド | SCNN1A, SCNN1B, SCNN1G | アミロライド感受性上皮ナトリウムチャネル | 集合管 | ||||
AR – 常染色体劣性遺伝性。 AD – 常染色体優性。
SGLT2 inhibitor (glucuretics) は2型糖尿病の管理のための新しい薬です。治療中にポラキ尿や多尿などの浸透圧利尿関連事象が観察されることがあります。
Bartter遺伝子には種類があるが、これはfurosemidを模倣するものである。
低カリウム血症の考え方
GSは低カリウム血症が最も多いので、家族性低マグネシウム血症とも呼ばれる。 低カリウム血症で尿細管症が疑われる患者には、高カリウム血症を確認する必要がある。 腎性カリウム消耗症は、TKKG、FeK、ランダムK/Cr比の計算、または24時間採尿後に証明することができる(表1)。 カリウム尿の評価は、患者が利尿剤やカリウム補給剤を服用していない場合、およびカリウム値が低い場合に行う必要がある。 カリウム排泄量が30mmol/l以下でTTKGが低い場合、低カリウム血症は腎外喪失または細胞内K+シフトが原因である。 多くの場合、これらの簡単な検査で診断は十分である。 最近注目されているのは原発性アルドステロン症である。 低カリウム血症は、PAの「古典的」な症状のひとつであるが、考えられていたほど一般的ではない。20 しかし、APの診断にはゴールドスタンダードがないため、AHと低カリウム血症の患者におけるRAA軸について覚えておく価値がある19。
低マグネシウム血症の診断
低マグネシウム血症はGS患者によくみられる異常であるが、すべての症例にみられるわけではない。22
カリウムイオンと同様、マグネシウムも糸球体で自由にろ過される。 濾過されたMg2+の10%は近位尿細管で吸収され、50-70%はHenleループの上行肢で吸収される。 遠位での再吸収は上皮のMg2+ TRPM6チャンネルに依存する。 マグネシウム尿は経口摂取量に依存し、腎臓のMg2+消耗を確認するためにFeMgを算出する必要がある(FeMg=(尿マグネシウム×血清クレアチニン)/×100)。 FeMgが2%未満であれば、摂取量の不足、消化管からの損失、細胞内へのMgの移行が示唆される。 4%以上の場合は腎臓のMg2+の消耗を示唆する。 腎臓のMg消耗が証明された場合、無作為にCa/Cr比を計算する必要がある。 尿中 Ca/Cr 比 0.3 は Bartter 症候群の高尿酸血症に典型的であり、正常カルシウム尿を伴う孤立性劣性低マグネシウム血症、高カルシウム尿症と腎石灰化を伴う家族性低マグネシウム血症、高カルシウム尿症を伴う常染色体優性低カルシウム血症、ループ利尿剤治療といくつかのネフロ毒素によるネフロピーがこれに該当する23。
マグネシウムとカリウムのホメオスタシスは互いに関連しており、低マグネシウム血症を是正しない限りカリウムの枯渇は改善しない23。平均して、患者は最大500mEqのカリウム、4-5mg/kg/日の塩化マグネシウムを5-10mg投与する必要がある。 アミロライド(5-10mg/日)、スピロノラクトン(200-300mg)が有効である。3
診断には臨床症状と検査結果が不可欠である。 典型的な表現型の症例では、診断を確定するためにサイアザイドテストを行うことを推奨する著者もいる。24 本症例では、遺伝子調査によりSLC12A3遺伝子に2つの新規変異があることが判明した。 本症例では遺伝子検査によりSLC12A3遺伝子に2つの新規変異が見つかり、NCCTの機能変異の欠如が原因である可能性が示された。 本論文では,低カリウム血症に対する非常にシンプルなアプローチを覚え,利尿剤の作用と遺伝性尿細管症との類似性を認識すれば,診断は極めて容易であることを示した。 低カリウム血症は、他の尿細管症(後天性、遺伝性)や他の低カリウム血症の原因(Conn病など)と鑑別する必要がある。 家族歴から無症状の低カリウム血症患者を発見することができる。 適切な治療により、危険な合併症から患者を守ることができる。
