US Pharm. 2020;45(5)(Specialty&Oncology suppl):3-8.
ABSTRACT: In recent years, several new targeted therapy options have been developed to combat resistance to traditional endocrine therapy for advanced breast cancer. Trzy inhibitory CDK4/6 (palbociclib, ribociclib i abemaciclib) zostały zatwierdzone do stosowania u chorych na zaawansowanego raka piersi z dodatnim receptorem hormonalnym i ujemnym receptorem 2 ludzkiego naskórkowego czynnika wzrostu. Każdy z tych leków wykazał swoją skuteczność, ale istnieją różnice między nimi, szczególnie w profilach działań niepożądanych.
Rak piersi jest najczęstszym typem nowotworu u kobiet, z ponad 276 000 nowych przypadków szacowanych w 2020 roku.1 Hormonalnie dodatni (HR+) rak piersi, który stanowi ponad 70% tych przypadków, był w przeszłości leczony za pomocą terapii endokrynologicznej (ET), takiej jak selektywne inhibitory receptora estrogenowego i inhibitory aromatazy (AI). Mimo że ET pozostaje podstawą leczenia raka piersi HR+, oporność rozwija się nawet u 50% chorych na zaawansowanego raka piersi.2 W celu zwalczania oporności w raku piersi HR+ zatwierdzono terapie celowane.3,4
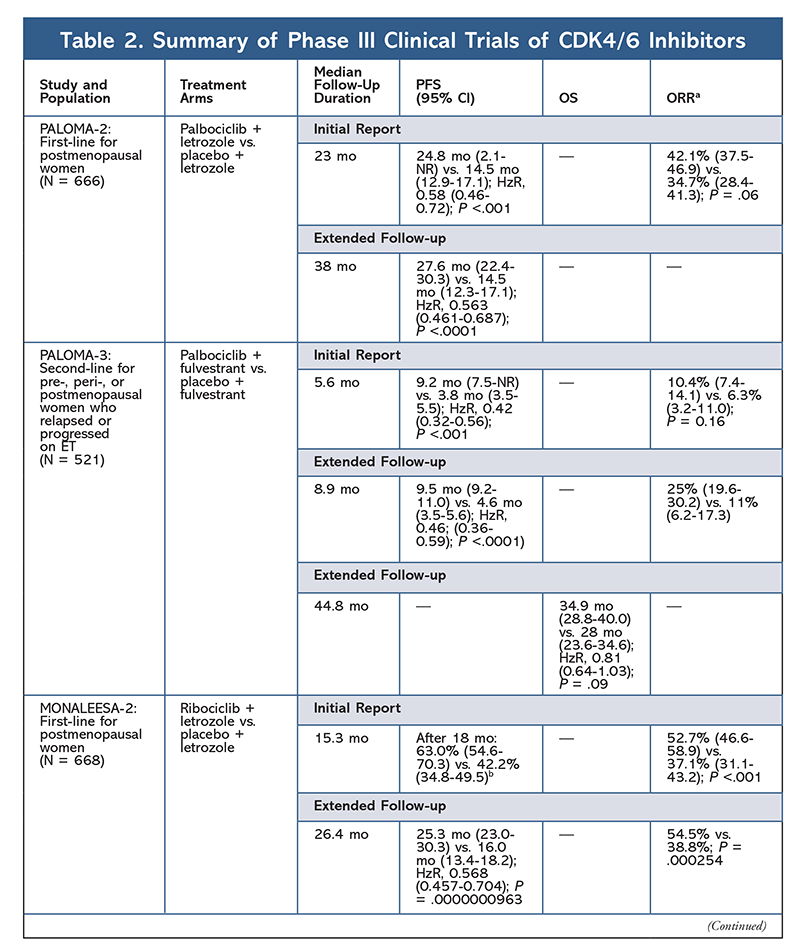
Inhibitory kinazy zależnej od cykliny (CDK), najnowsza klasa leków stosowanych w zaawansowanym raku piersi, działają poprzez swoiste hamowanie białek CDK4/6 i blokowanie przejścia z fazy G1 do fazy S cyklu komórkowego. Ta klasa leków hamuje aktywność kinazy, która fosforyluje białkowy szlak retinoblastoma. Blokując ten szlak, inhibitory CDK4/6 są w stanie zablokować progresję cyklu komórkowego w połowie fazy G1 i zapobiec progresji komórek nowotworowych. W ostatnich latach trzy inhibitory CDK4/6 (palbociclib, ribociclib i abemaciclib) zostały dopuszczone do stosowania jako terapie skojarzone w zaawansowanych lub przerzutowych rakach piersi HR+, z negatywnym receptorem 2 ludzkiego naskórkowego czynnika wzrostu (HER2-).5-8 W niniejszym artykule omówiono różnice między tymi lekami (tab. 1), wyniki badań klinicznych III fazy (tab. 2) oraz profile działań niepożądanych (tab. 3).
Palbociclib
W 2015 roku palbociclib został pierwszym inhibitorem CDK4/6, który uzyskał akceptację FDA w leczeniu raka piersi HR+, HER2- (w połączeniu z AI jako początkowa ET u kobiet po menopauzie lub u mężczyzn, lub w połączeniu z fulwestrantem u chorych z progresją choroby po ET).6,9-14 Palbociclib uzyskał początkowo akceptację po uzyskaniu pozytywnych wyników badania II fazy PALOMA-1, w którym porównano palbociclib plus letrozol z samym letrozolem jako początkową terapię u chorych na zaawansowanego raka piersi leczonych ET-naiwnie.9
Wyniki te doprowadziły do przeprowadzenia dwóch badań III fazy, w których dalej oceniano działanie palbociclibu w tej populacji chorych. Wstępne wyniki badania PALOMA-2 potwierdziły działanie palbociclibu plus letrozolu, wykazując poprawę przeżycia wolnego od progresji choroby (PFS, progression-free survival) w porównaniu z samym letrozolem (odpowiednio 24,8 mo vs. 14,5 mo; iloraz zagrożeń dla progresji choroby lub zgonu, 0,58; 95% CI, 0,46-0,72; P <.001). Długoterminowe badanie kontrolne trwające 38 miesięcy dodatkowo potwierdziło wpływ palbociclibu na PFS, z wydłużeniem do 27,6 miesiąca w porównaniu z 14,5 miesiąca w przypadku samego letrozolu (HzR, 0,563; 95% CI, 0,461-0,687; P <,0001). W badaniu kontynuacyjnym odnotowano również stałą poprawę PFS w przypadku stosowania palbociclibu plus letrozolu we wszystkich badanych podgrupach, a także opóźnienie mediany czasu do rozpoczęcia kolejnej terapii. Jednak dane dotyczące całkowitego przeżycia (overall survival, OS) dla raportów początkowego i uzupełniającego były niedojrzałe, a włączone do badania chore są obserwowane pod kątem przeżycia.10,11
Krótko po rozpoczęciu badania PALOMA-2 rozpoczęto kolejne badanie III fazy, PALOMA-3, oceniające bezpieczeństwo i skuteczność palbociclibu plus fulwestrantu u kobiet przed lub po menopauzie z zaawansowanym rakiem piersi HR+, u których nastąpiła progresja po wcześniejszej ET. We wstępnym raporcie po 5,6 miesiąca obserwacji wykazano poprawę mediany PFS (9,2 mo vs. 3,8 mo), z 58-procentową redukcją progresji (HzR, 0,42; 95% CI, 0,32-0,56; P <.001).12 We wstępnie określonej analizie OS w badaniu PALOMA-3, z medianą obserwacji wynoszącą 44.8 miesięcy, stwierdzono, że różnice w OS w całej grupie leczonej intencjonalnie nie osiągnęły znamienności statystycznej, ale połączenie to wydłużyło OS o 10 miesięcy u chorych, którzy byli wrażliwi na wcześniejszą ET.14
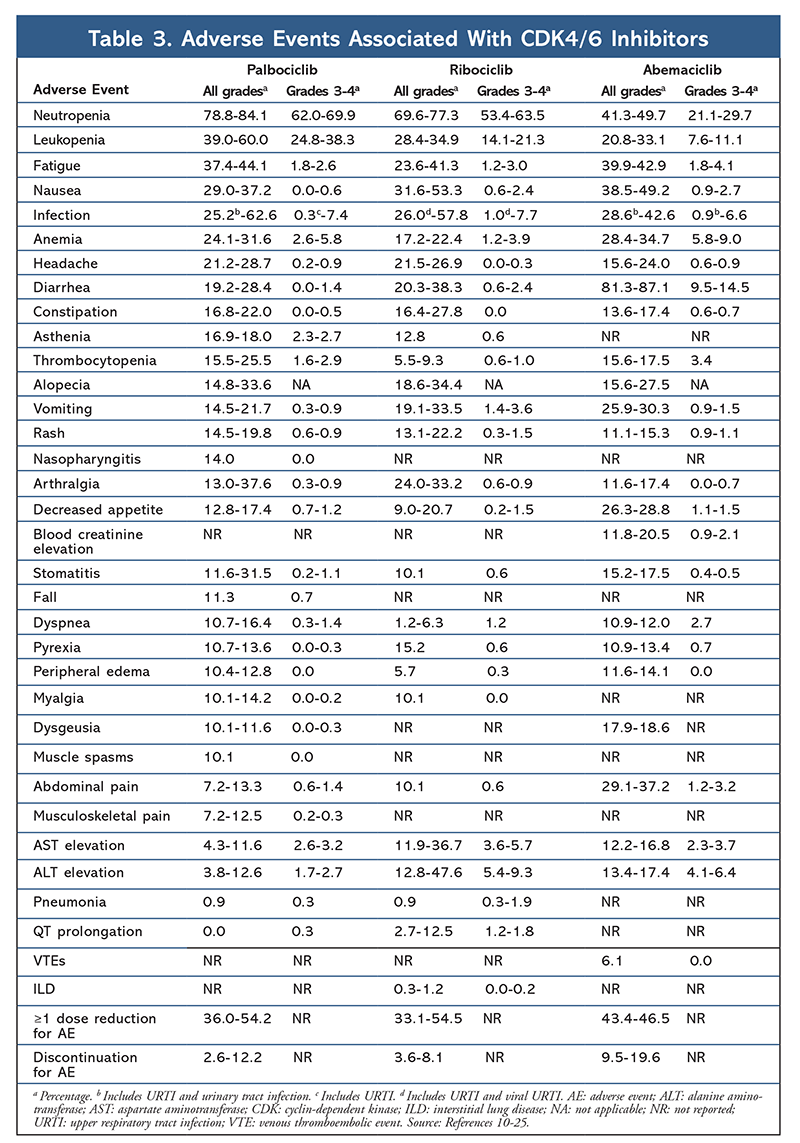
Profil działań niepożądanych pozostał spójny we wszystkich raportach z badań (TABELA 3), a najczęściej zgłaszanymi działaniami niepożądanymi były neutropenia (78,8%-84,1%), leukopenia (39%-60%) i zmęczenie (37,4%-44,1%). Częstość występowania neutropenii była wysoka, jednak neutropenia gorączkowa występowała rzadko (do 2%). Ogólną tolerancję palbociclibu uznano za możliwą do opanowania, a środek ten przyniósł pozytywne dane dotyczące jakości życia, gdy był stosowany w terapii skojarzonej w porównaniu z monoterapią endokrynologiczną.9,14
Ribociclib
Drugi inhibitor CDK4/6, ribociclib, został zatwierdzony przez FDA w 2017 roku z szerszą wskazaną populacją pacjentów. Rybocyklib jest dopuszczony do stosowania u kobiet po menopauzie oraz w okresie przed- lub okołomenopauzalnym z zaawansowanym lub przerzutowym rakiem piersi HR+, HER2- (jako terapia skojarzona z AI jako początkowa ET lub, u kobiet po menopauzie, w połączeniu z fulwestrantem jako początkowa ET lub po progresji choroby na ET).7
Ryboklib po raz pierwszy uzyskał zatwierdzenie FDA po tym, jak w badaniu MONALEESA-2 stwierdzono poprawę PFS, gdy lek podawano w skojarzeniu z letrozolem w porównaniu z samym letrozolem. Wskaźniki ocenianego miejscowo PFS w porównaniu z samym letrozolem po 18 miesiącach wynosiły odpowiednio 63,0% (95% CI, 54,6-70,3) i 42,2% (95% CI, 34,8-49,5).15 W sprawozdaniu dotyczącym przedłużonej obserwacji po 26,4 miesiącach dodatkowo wykazano skuteczność i tolerancję tego połączenia.16 Mimo poprawy PFS dane dotyczące OS w badaniu MONALEESA-2 pozostają niedojrzałe.
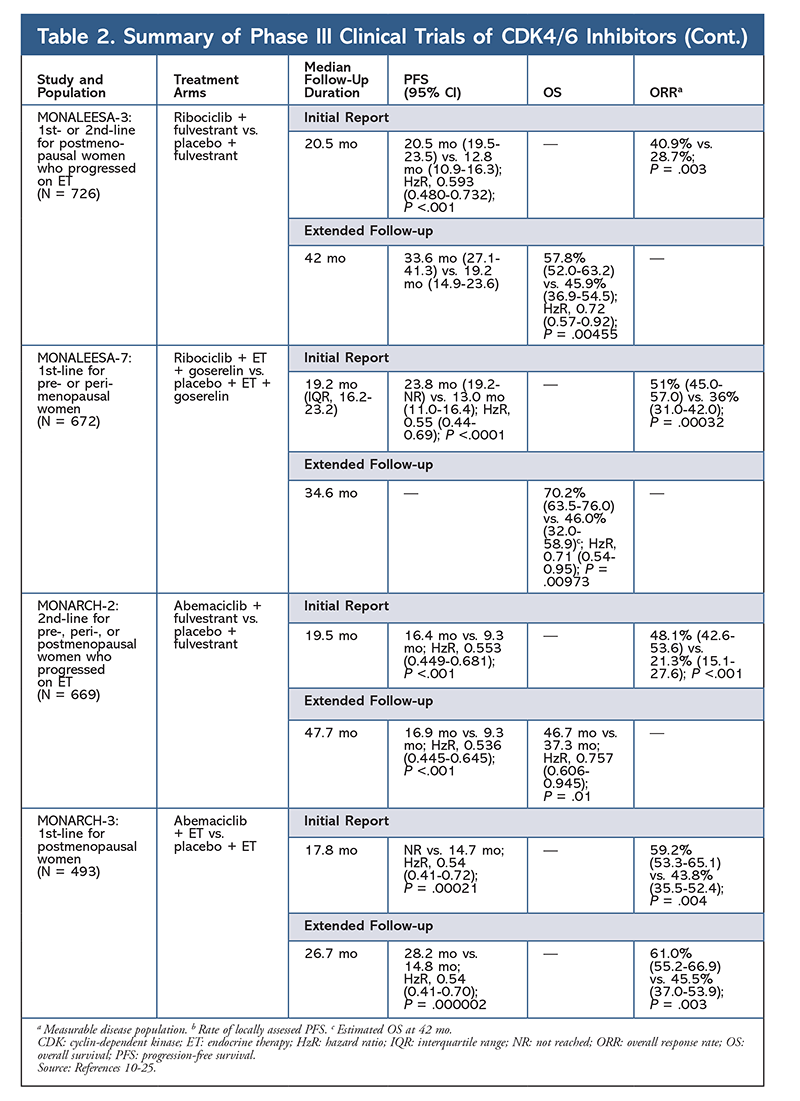
Ribociclib jest również badany (w badaniu MONALEESA-3) w skojarzeniu z fulwestrantem u chorych nienawykłych do leczenia oraz u chorych, u których doszło do nawrotu choroby po ET. Pierwsze doniesienie wykazało poprawę PFS dla tego połączenia w porównaniu z samym fulwestrantem (odpowiednio 20,5 roku vs. 12,8 roku; HzR, 0,593; 95% CI, 0,480-0,732; P <.001), co doprowadziło do zatwierdzenia tego połączenia przez FDA.17 Drugie i najnowsze doniesienie dotyczące inhibitora CDK4/6, obejmujące 21,6 dodatkowych miesięcy obserwacji, wykazało dalszą stałą poprawę PFS. W raporcie tym potwierdzono również korzyść w zakresie OS wynikającą ze stosowania rybociclibu i fulwestrantu w porównaniu z samym fulwestrantem, z szacunkowym OS po 42 miesiącach wynoszącym odpowiednio 57,8% i 45,9% oraz zmniejszeniem względnego ryzyka zgonu o 28% (HzR, 0,72; 95% CI, 0,57-0.92; P = .00455).18
Trzecie badanie kliniczne, MONALEESA-7, jest obecnie jedynym badaniem III fazy oceniającym skuteczność i bezpieczeństwo stosowania inhibitora CDK4/6 jako terapii pierwszego rzutu u kobiet przed lub w okresie okołomenopauzalnym, u których występuje rak piersi z przerzutami. W badaniu tym rybocyklib plus tamoksyfen lub niesteroidowy lek przeciwzapalny (NLPZ) – taki jak letrozol lub anastrozol – plus goserelina znacząco poprawiły PFS o 23,8 miesiąca w porównaniu z 13 miesiącami w grupie placebo (HzR, 0,55; 95% CI, 0,44-0,69; P <.0001), a połączenie to doprowadziło do rozszerzenia wskazań do leczenia o kobiety w okresie przed- i okołomenopauzalnym.19 W raporcie z rozszerzonej obserwacji wykazano korzyść w zakresie OS w przypadku połączenia ryboklibu plus tamoksyfenu lub NLPZ plus gosereliny w porównaniu z placebo, z szacowanym 42-miesięcznym OS wynoszącym 70,2% w porównaniu z 46,0%.20
Profil toksyczności ryboklibu jest bardzo podobny do profilu toksyczności palbociclibu, przy czym neutropenia i leukopenia są najczęściej zgłaszanymi ciężkimi AE (stopnie 3/4), chociaż z mniejszą częstością niż w przypadku palbociclibu (TABELA 3).15-20 Neutropenia gorączkowa występowała rzadko, a w żadnym z raportów z przedłużonej obserwacji nie pojawiły się nowe obawy dotyczące bezpieczeństwa w związku z dłuższą ekspozycją na rybocyklib.
Abemaciclib
Trzecim inhibitorem CDK4/6 zatwierdzonym przez FDA jest abemaciclib. Środek ten jest wskazany w skojarzeniu z AI jako początkowy ET u kobiet po menopauzie z zaawansowanym rakiem piersi lub w skojarzeniu z fulwestrantem u kobiet przed, około lub po menopauzie z progresją choroby po ET. Abemaciclib jest także dopuszczony do stosowania w monoterapii u mężczyzn i kobiet z progresją choroby po ET i wcześniejszej chemioterapii w przerzutach.6 Preparat ten początkowo uzyskał akceptację na podstawie wyników badania MONARCH-1, w którym wykazano obiecującą aktywność kliniczną po 12 miesiącach, z całkowitym odsetkiem odpowiedzi (overall response rate, ORR) wynoszącym 19,7% (95% CI, 13,3-27,5) i medianą PFS wynoszącą 6 miesięcy.5,21 W tym czasie abemaciclib był także badany w badaniu MONARCH-2 u kobiet przed-, około- i pomenopauzalnych, u których doszło do progresji choroby po ET. W badaniu tym wykazano istotną statystycznie korzyść w zakresie PFS w przypadku połączenia abemacyklibu i fulwestrantu w porównaniu z samym fulwestrantem (16,4 mo vs. 9,3 mo; HzR, 0,553; 95% CI, 0,449-0,681; P <.001).22 W przedłużonym badaniu z medianą czasu trwania 47.7 miesięcy odnotowano nieznacznie lepsze wyniki w zakresie PFS i OS w przypadku połączenia abemacyklibu z placebo i fulwestrantem (46,7 mo vs. 37,3 mo; 95% CI, 0,606-0,945; P = .01).23
Krótko po rozpoczęciu dwóch badań z abemacyklibem rozpoczęto badanie MONARCH-3. W badaniu tym stwierdzono istotną statystycznie poprawę PFS i ORR w przypadku stosowania abemacyklibu plus NLPZ w porównaniu z ramieniem placebo-plus-NSAI jako leczenia pierwszego rzutu u kobiet po menopauzie. Zaktualizowane doniesienie z 8,9-miesięczną dodatkową obserwacją dodatkowo potwierdziło wyniki PFS i ORR uzyskane we wstępnej analizie; dane dotyczące OS pozostają jednak niedojrzałe, a ostateczna analiza OS zostanie przeprowadzona po 315 zdarzeniach.24,25
Ogółem zauważono, że abemaciclib jest najsilniejszym inhibitorem CDK4/6, o doskonałej aktywności w ośrodkowym układzie nerwowym ze względu na swoją strukturę, co pozwala mu przekraczać barierę krew-mózg i dłużej pozostawać w celu leczenia.5 Może to być korzystne u chorych z przerzutami do mózgu. Chociaż abemaciclib również charakteryzuje się wysokim odsetkiem hematologicznych AE, wskaźniki te są znacznie niższe niż w przypadku innych inhibitorów CDK4/6. Abemaciclib wiąże się z większą liczbą toksyczności żołądkowo-jelitowych, takich jak biegunka, niż inne inhibitory CDK4/6 (wszystkie stopnie: 81,3%-87,1%; stopnie 3-4: 9,5%-14,5%).22-25
Rola farmaceuty
Ogółem profile AE różnych inhibitorów CDK 4/6 są podobne, ale każdy lek ma unikalne AE. Najczęstsze AE zgłaszane w przypadku inhibitorów CDK4/6 to neutropenia, leukopenia, zmęczenie, nudności, zakażenia, bóle stawów, niedokrwistość, ból głowy i biegunka (TABELA 3). Poza neutropenią i leukopenią, większość pacjentów zgłaszała AE stopnia 1 lub 2. Neutropenia i leukopenia stopnia 3 lub 4, które były bardzo częste w przypadku wszystkich inhibitorów CDK, szczególnie palbociclibu i rybociclibu, były leczone głównie poprzez przerwanie podawania dawki i (lub) jej zmniejszenie. Morfologia krwi pacjenta powinna być monitorowana na początku, co 2 tygodnie przez pierwsze dwa cykle, na początku każdego z kolejnych czterech cykli oraz w razie konieczności klinicznej w celu supresji szpiku kostnego.6-8 Upadki, skurcze mięśni i zapalenie jamy nosowo-gardłowej są związane ze stosowaniem palbociclibu, ale w większości przypadków mają łagodny przebieg.10,11,14 W przypadku ryboklibu zgłaszano niewielką częstość występowania wydłużenia odstępu QT.15-20 Abemaciclib był związany z istotnie większą częstością występowania biegunki w porównaniu z palboklibem i ryboklibem; przypadki te występowały głównie podczas pierwszego cyklu i można je było opanować za pomocą leczenia przeciwbiegunkowego.22-25 Abemaciclib był związany z podwyższeniem stężenia kreatyniny w surowicy i żylnymi zdarzeniami zakrzepowo-zatorowymi (w większości łagodnymi), których nie zgłaszano w przypadku palbociclibu i rybociclibu, a także z większą częstością występowania bólu brzucha.22-25 Co warte podkreślenia, we wrześniu 2019 roku FDA ostrzegła, że u pacjentów leczonych inhibitorami CDK4/6 może wystąpić rzadka, ale ciężka, zagrażająca życiu lub śmiertelna śródmiąższowa choroba płuc (ILD) i zapalenie płuc.26. Dlatego pacjentów należy regularnie monitorować pod kątem objawów płucnych wskazujących na ILD i/lub zapalenie płuc.
Wniosek
Zatwierdzenie palbociclibu, rybociclibu i abemaciclibu w ostatnich latach rozszerzyło możliwości leczenia pacjentów z zaawansowanym rakiem piersi. Mimo że wszystkie te leki mają ten sam mechanizm działania, różnią się nieznacznie pod względem skuteczności i bezpieczeństwa. W wielu trwających badaniach, poza wymienionymi w tym przeglądzie, kontynuowane są badania nad tymi inhibitorami w różnych populacjach chorych i w różnych kombinacjach leczenia. Potencjał tych leków do rozszerzenia zakresu stosowania inhibitorów CDK4/6 na inne grupy niż HR+, HER2- zaawansowany rak piersi wydaje się obiecujący.27
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020;70(1):7-30.
2. Preusser M, De Mattos-Arruda L, Thill M, et al. CDK4/6 inhibitors in the treatment of patients with breast cancer: summary of a multidisciplinary round-table discussion. ESMO Open. 2018;3(5):e000368.
3. Tripathy D, Bardia A, Sellers WR. Ribociclib (LEE011): mechanizm działania i wpływ kliniczny tego selektywnego inhibitora kinazy zależnej od cykliny 4/6 w różnych guzach litych. Clin Cancer Res. 2017;23(13):3251-3262.
4. Portman N, Alexandrou S, Carson E, et al. Overcoming CDK4/6 inhibitor resistance in ER-positive breast cancer. Endocr Relat Cancer. 2019;26(1):R15-R30.
5. Sobhani N, D’Angelo A, Pittacolo M, et al. Updates on the CDK4/6 inhibitory strategy and combinations in breast cancer. Cells. 2019;8(4):E321.
6. Ibrance (palbociclib) ulotka dołączona do opakowania. New York, NY: Pfizer Inc; wrzesień 2019.
7. Kisqali (ribociclib) ulotka dołączona do opakowania. East Hanover, NJ: Novartis Pharmaceuticals Corp; wrzesień 2019 r.
8. Ulotka dołączona do opakowania Verzenio (abemaciclib). Indianapolis, IN: Eli Lilly and Co; wrzesień 2019 r.
9. Finn RS, Crown JP, Lang I, et al. The cyclin-dependent kinase 4/6 inhibitor palbociclib in combination with letrozole versus letrozole alone as first-line treatment of oestrogen receptor-positive, HER2-negative, advanced breast cancer (PALOMA-1/TRIO-18): a randomised phase 2 study. Lancet Oncol. 2015;16(1):25-35.
10. Finn RS, Martin M, Rugo HS, et al. Palbociclib i letrozol w zaawansowanym raku piersi. N Engl J Med. 2016;375(20):1925-1936.
11. Rugo HS, Finn RS, Diéras V, et al. Palbociclib plus letrozol as first-line therapy in estrogen receptor-positive/human epidermal growth factor receptor 2negative advanced breast cancer with extended follow-up. Breast Cancer Res Treat. 2019;174(3):719-729.
12. Turner NC, Ro J, André F, et al. Palbociclib in hormone-receptor-positive advanced breast cancer. N Engl J Med. 2015;373(3):209-219.
13. Cristofanilli M, Turner NC, Bondarenko I, et al. Fulvestrant plus palbociclib versus fulvestrant plus placebo for treatment of hormone-receptor-positive, HER2-negative metastatic breast cancer that progressed on previous endocrine therapy (PALOMA-3): final analysis of the multicentre, double-blind, phase 3 randomised controlled trial. Lancet Oncol. 2016;17(4):425-439.
14. Turner NC, Slamon DJ, Ro J, et al. Overall survival with palbociclib and fulvestrant in advanced breast cancer. N Engl J Med. 2018;379(20):1926-1936.
15. Hortobagyi GN, Stemmer SM, Burris HA, et al. Ribociclib jako terapia pierwszej linii dla HR-dodatniego, zaawansowanego raka piersi. N Engl J Med. 2016;375(18):1738-1748.
16. Hortobagyi GN, Stemmer SM, Burris HA, et al. Updated results from MONALEESA-2, a phase III trial of first-line ribociclib plus letrozole versus placebo plus letrozole in hormone receptor-positive, HER2-negative advanced breast cancer. Ann Oncol. 2018;29(7):1541-1547.
17. Slamon DJ, Neven P, Chia S, et al. Randomizowane badanie III fazy ribociclibu i fulwestrantu w hormonalnie dodatnim, ludzkim receptorze naskórkowego czynnika wzrostu (human epidermal growth factor receptor 2-negative) zaawansowanym raku piersi: MONALEESA-3. J Clin Oncol. 2018;36(24):2465-2472.
18. Slamon DJ, Neven P, Chia S, et al. Overall survival with ribociclib plus fulvestrant in advanced breast cancer. N Engl J Med. 2020;382(6):514-524.
19. Tripathy D, Im SA, Colleoni M, et al. Ribociclib plus endocrine therapy for premenopausal women with hormone-receptor-positive, advanced breast cancer (MONALEESA-7): a randomised, phase 3 trial. Lancet Oncol. 2018;19(7):904-915.
20. Im SA, Lu YS, Bardia A, et al. Overall survival with ribociclib plus endocrine therapy in breast cancer. N Engl J Med. 2019;381(4):307-316.
21. Dickler MN, Tolaney SM, Rugo HS, et al. MONARCH 1, badanie II fazy abemaciclibu, inhibitora CDK4 i CDK6, jako pojedynczego leku, u chorych na opornego na leczenie HR+/HER2- przerzutowego raka piersi. Clin Cancer Res. 2017;23(17):5218-5224.
22. Sledge GW Jr, Toi M, Neven P, et al. MONARCH 2: abemaciclib w połączeniu z fulwestrantem u kobiet z HR+/HER2- zaawansowanym rakiem piersi, u których doszło do progresji w trakcie otrzymywania terapii endokrynologicznej. J Clin Oncol. 2017;35(25):2875-2884.
23. Sledge GW Jr, Toi M, Neven P, et al. The effect of abemaciclib plus fulvestrant on overall survival in hormone receptor-positive, ERBB2-negative breast cancer that progressed on endocrine therapy-MONARCH 2: a randomized clinical trial. JAMA Oncol. 2020;6(1):116-124.
24. Goetz MP, Toi M, Campone M, et al. MONARCH 3: abemaciclib as initial therapy for advanced breast cancer. J Clin Oncol. 2017;35(32):3638-3646.
25. Johnston S, Martin M, Di Leo A, et al. MONARCH 3 final PFS: a randomized study of abemaciclib as initial therapy for advanced breast cancer. NPJ Breast Cancer. 2019;17(5):5.
26. FDA. FDA ostrzega przed rzadkim, ale ciężkim zapaleniem płuc w przypadku stosowania leków Ibrance, Kisqali i Verzenio w leczeniu raka piersi. www.fda.gov/drugs/drug-safety-and-availability/fda-warns-about-rare-severe-lung-inflammation-ibrance-kisqali-and-verzenio-breast-cancer. Dostęp 15 stycznia, 2020.
27. Shah M, Nunes MR, Stearns V. CDK4/6 inhibitors: game changers in the management of hormone receptor-positive advanced breast cancer? Oncology (Williston Park). 2018;32(5):216-222.
Treść zawarta w tym artykule służy wyłącznie celom informacyjnym. Treść ta nie ma na celu zastąpienia profesjonalnej porady. Poleganie na jakichkolwiek informacjach zawartych w tym artykule odbywa się wyłącznie na własne ryzyko.
.
