Momentos Dipolo
A distribuição assimétrica de carga numa substância polar como o HCl produz um momento dipolo onde \( Qr \) em metros (m). é abreviado pela letra grega mu (µ). O momento dipolo é definido como o produto da carga parcial Q sobre os átomos colados e a distância r entre as cargas parciais.
Quando uma molécula com um momento dipolo é colocada num campo eléctrico, tende a orientar-se com o campo eléctrico devido à sua distribuição assimétrica de carga (Figura \PageIndex{4}}).
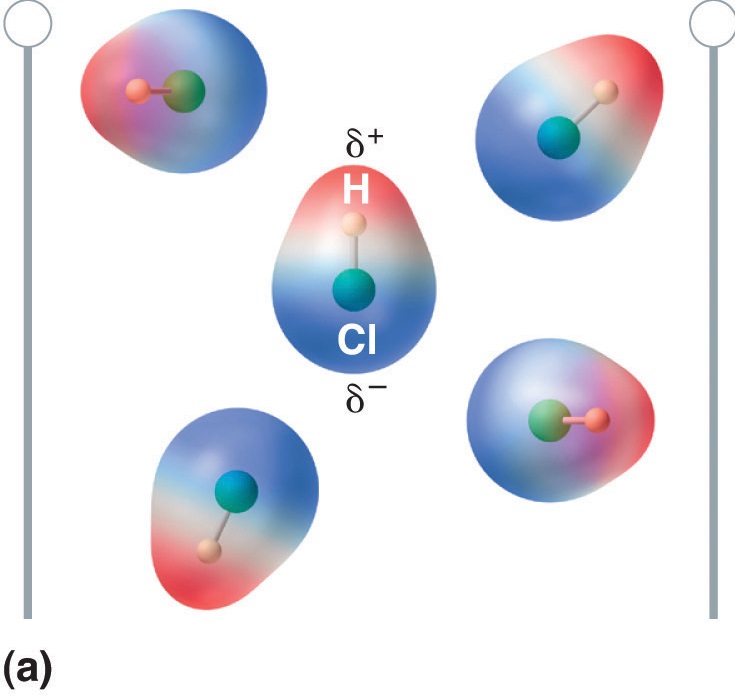
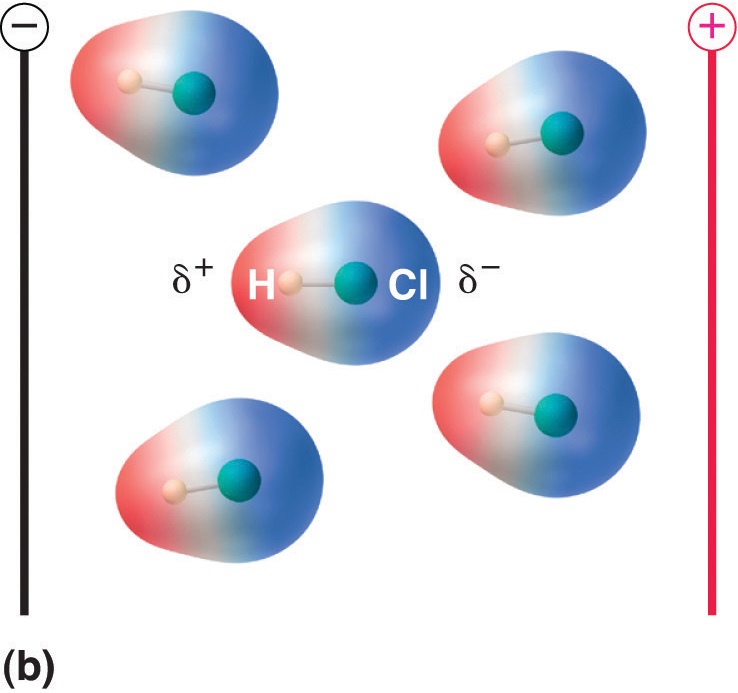
Figure \PageIndex{5}): Moléculas que Possuem um Momento de Dipolo Alinham-se Parcialmente com um Campo Eléctrico Aplicado. Na ausência de um campo (a), as moléculas de HCl são orientadas aleatoriamente. Quando um campo elétrico é aplicado (b), as moléculas tendem a se alinhar com o campo, de tal forma que a extremidade positiva do dipolo molecular aponta para o terminal negativo e vice-versa.
O momento dipolo medido do HCl indica que a ligação H-Cl tem aproximadamente 18% de caráter iônico (0,1811 × 100), ou 82% de caráter covalente. Em vez de escrever HCl como
\
podemos portanto indicar quantitativamente a separação de carga como
\\
os nossos resultados calculados estão de acordo com a diferença de eletronegatividade entre hidrogênio e cloro χH = 2,20; χCl = 3,16, χCl – χH = 0,96), um valor bem dentro da faixa para ligações polares covalentes. Indicamos o momento dipolo escrevendo uma seta acima da molécula. Matematicamente, os momentos dipolo são vetores, e possuem tanto uma magnitude quanto uma direção. O momento dipolo de uma molécula é a soma vectorial dos dipolos das ligações individuais. Em HCl, por exemplo, o momento dipolo é indicado da seguinte forma:
![]()
![]()
A seta mostra a direcção do fluxo de electrões apontando para o átomo mais electronegativo.
A carga sobre os átomos de muitas substâncias na fase gasosa pode ser calculada utilizando os momentos dipolo medidos e as distâncias de ligação. A figura \(\PageIndex{6}) mostra um gráfico da percentagem de carácter iónico versus a diferença de electronegatividade dos átomos ligados para várias substâncias. De acordo com o gráfico, a ligação em espécies como NaCl(g) e CsF(g) é substancialmente inferior a 100% de carácter iónico. Como o gás se condensa num sólido, no entanto, as interacções dipolo-dipolo entre espécies polarizadas aumentam as separações de carga. No cristal, portanto, um elétron é transferido do metal para o não-metal e estas substâncias se comportam como compostos iônicos clássicos. Os dados da Figura 6 mostram que espécies diatómicas com uma diferença de electronegatividade inferior a 1,5 são menos de 50% de carácter iónico, o que é consistente com a nossa anterior descrição destas espécies como contendo ligações polares covalentes. O uso de momentos dipolo para determinar o caráter iônico de uma ligação polar é ilustrado em Exemplo \(\PageIndex{2}\).
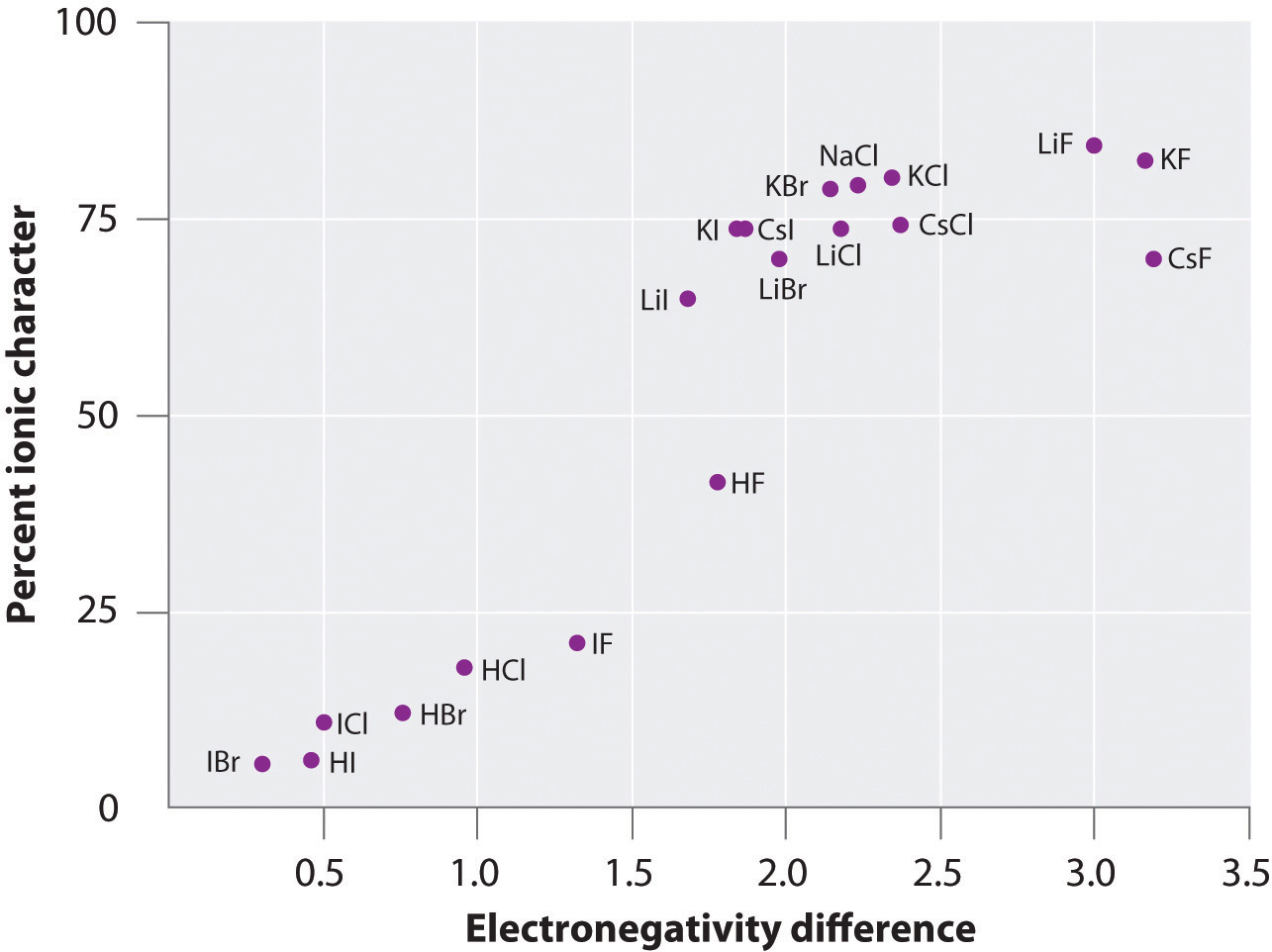
Figure \(\PageIndex{6}}): Um Gráfico do Carácter Iônico Percentual de uma Ligação, determinado a partir de Momentos Dipolo Medidos versus a Diferença de Eletronegatividade dos Átomos Ligados. Na fase gasosa, mesmo CsF, que tem a maior diferença possível na eletronegatividade entre os átomos, não é 100% iônico. O CsF sólido, entretanto, é melhor visto como 100% iônico devido às interações eletrostáticas adicionais na malha.
