Enthalpia
Termodinâmica é o estudo da relação entre calor (ou energia) e trabalho. A entalpia é um factor central na termodinâmica. É o conteúdo de calor de um sistema. O calor que passa para dentro ou fora do sistema durante uma reacção é a mudança de entalpia. Se a entalpia do sistema aumenta (isto é, quando a energia é adicionada) ou diminui (porque a energia é dada) é um fator crucial que determina se uma reação pode acontecer.
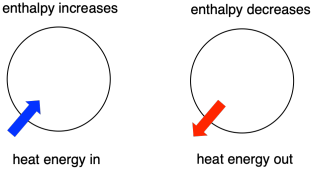
Por vezes, chamamos de “entalpia interna” a energia das moléculas em processo de mudança. Às vezes, chamamos-lhe a “entalpia do sistema”. Estas duas frases referem-se à mesma coisa. Da mesma forma, a energia das moléculas que não participam da reação é chamada de “entalpia externa” ou “entalpia do entorno”.
Em termos gerais, as mudanças de energia que vimos na introdução à termodinâmica foram mudanças na entalpia. Veremos na próxima secção que existe um outro factor energético, a entropia, que também temos de considerar nas reacções. Por agora, vamos apenas olhar para a entalpia.
- Entalpia é o conteúdo de calor de um sistema.
- A mudança de entalpia de uma reacção é aproximadamente equivalente à quantidade de energia perdida ou ganha durante a reacção.
- Uma reacção é favorecida se a entalpia do sistema diminuir em relação à reacção.
Esta última afirmação é muito parecida com a descrição da energia na página anterior. Se um sistema sofre uma reação e libera energia, o seu próprio conteúdo energético diminui. Ele tem menos energia sobrando se ele der alguma. Porque é que a energia de um conjunto de moléculas muda quando ocorre uma reacção? Para responder a isso, precisamos pensar sobre o que acontece em uma reação química.
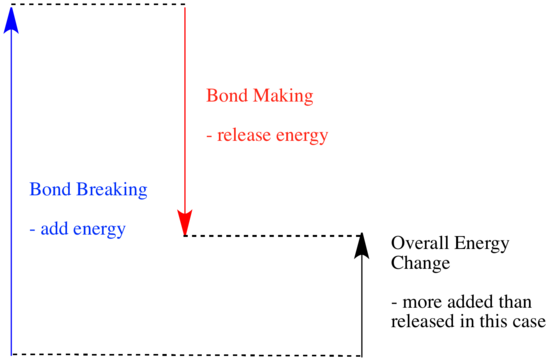
Numa reacção, há uma mudança na ligação química. Algumas das ligações nos reagentes são quebradas, e novas ligações são feitas para formar os produtos. A quebra das ligações custa energia, mas a energia é libertada quando são feitas novas ligações.
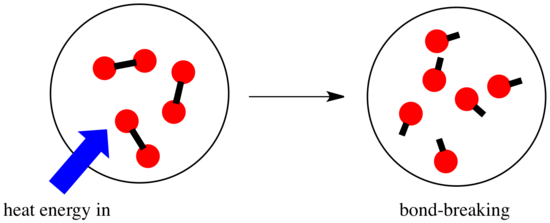
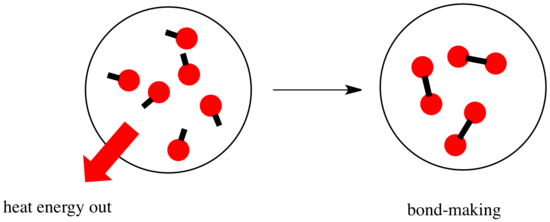
Se uma reacção é capaz de avançar pode depender do equilíbrio entre estas etapas de desbaste e quebra de ligações.
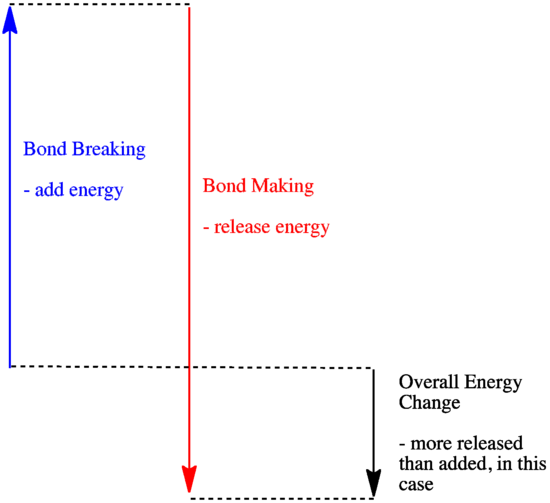
- Uma reacção é exotérmica se for libertada mais energia pela formação de novas ligações do que se for consumida pela quebra de ligações antigas.
- Uma reacção é exotérmica se as ligações mais fracas forem trocadas por mais fortes.
- Uma reacção é endotérmica se a quebra de ligações custar mais energia do que a que é fornecida na criação de ligações.
As energias das ligações (a quantidade de energia que deve ser adicionada para quebrar uma ligação) são um factor importante para determinar se uma reacção irá ocorrer. As forças de ligação nem sempre são fáceis de prever, porque a força de uma ligação depende de uma série de factores. No entanto, muitas pessoas têm feito muito trabalho medindo a força de um vínculo, e têm coletado as informações em tabelas, então se você precisa saber o quão forte é um vínculo, você pode simplesmente procurar a informação que você precisa.
| Bond | Bond Energy (kcal/mol) | Bond Energy (kcal/mol) | Bond Energy (kcal/mol) |
| H-H | 104 | O-H | 111 |
| C-C | 83 | C-H | 99 |
| O=O | 119 | N-H | 93 |
| N=N | 226 | C=O | 180 |
Por exemplo, suponha que você queria saber se a combustão de metano era uma reação exotérmica ou endotérmica. Vou supor que seja exotérmica, porque esta reação (e outras como esta) é usada para fornecer calor para muitas casas através da queima de gás natural em fornos.
A “combustão” do metano significa que ele é queimado no ar, para que reaja com oxigênio. Os produtos da queima de hidrocarbonetos são, na sua maioria, dióxido de carbono e água. O átomo de carbono no metano (CH4) é incorporado em uma molécula de dióxido de carbono. Os átomos de hidrogénio são incorporados em moléculas de água. Existem quatro átomos de hidrogénio no metano, pelo que é suficiente para fazer duas moléculas de H2O.
- Quatro ligações C-H devem ser quebradas na combustão do metano.
- Quatro novas ligações O-H são feitas quando os hidrogénios do metano são adicionados a novas moléculas de água.
- Duas novas ligações C=O são feitas quando o carbono do metano é adicionado a uma molécula de CO2.
A outra peça do puzzle é a fonte de oxigénio para a reacção. O oxigênio está presente na atmosfera principalmente como O2. Porque precisamos de dois átomos de oxigénio na molécula de CO2 e mais dois átomos de oxigénio para as duas moléculas de água, precisamos de um total de quatro átomos de oxigénio para a reacção, que poderiam ser fornecidos por duas moléculas de O2.
-
Duas ligações O=O devem ser quebradas para fornecer os átomos de oxigénio para os produtos.
Junto, são quatro ligações C-H e duas ligações O=O quebradas, mais duas ligações C=O e quatro ligações O-H feitas. Isso é 4 x 99 kcal/mol para as ligações C-H e 2 x 119 kcal/mol para as ligações O=O, um total de 634 kJ/mol adicionados. A reação libera 2 x 180 kcal/mol para as ligações C=O e 4 x 111 kcla/mol para as ligações OH, totalizando 804 kcal/mol. No total, há 170 kcal/mol mais liberados do que são consumidos.
Isso significa que a reação é exotérmica, portanto produz calor. É provavelmente uma boa maneira de aquecer a sua casa.
