Introdução
Doença pulmonar obstrutiva crônica (DPOC) é uma causa significativa de mortalidade e morbidade em todo o mundo moderno. A taxa de mortalidade desta doença está aumentando e prevê-se que ela se tornará a terceira principal causa de morte no mundo em 2020.1 Não é possível definir COPD com base apenas no volume expiratório forçado no 1s (VEF1), portanto a Iniciativa Global para Doença Pulmonar Obstrutiva Crônica (GOLD) elaborou uma definição multidimensional para avaliar COPD.2 A nova definição inclui a prevalência de sintomas e o histórico anterior de exacerbações, além do valor de VEF1, e também enfatiza a avaliação de comorbidades. A fim de avaliar os sintomas, recomenda-se o Conselho de Pesquisa Médica (mMRC) modificado ou o Teste de Avaliação da DPOC (CAT). Além disso, foi utilizada uma escala de qualidade de vida específica da doença (SGRQ, SF-36, CCQ) para avaliar o impacto da doença na vida diária. Alguns estudos demonstraram uma forte relação entre o CAT e o Questionário Respiratório de São Jorge (SGRQ).3,4 Ladeira et al.5 mostraram que o CAT estava correlacionado com o índice BODE.
COPD é uma doença complexa e inclui componentes genéticos, celulares e moleculares. Há muitas células e moléculas diferentes envolvidas nas vias inflamatórias. Vários indicadores têm sido usados para demonstrar uma potencial inflamação sistêmica relacionada à doença.6-9 A inflamação das vias aéreas e do parênquima pulmonar é um importante mecanismo patogênico da DPOC. Além disso, a inflamação sistêmica persistente pode estar associada a várias comorbidades extrapulmonares e efeitos pulmonares.10 Pesquisas recentes têm fornecido provas da existência de um “novo fenótipo inflamatório sistêmico de DPOC” distinto. Em um estudo recente, foi demonstrado que comorbidade cardiovascular e diabetes estavam associados a níveis mais elevados para alguns marcadores de inflamação sistêmica.11 Portanto, a carga genética, inflamação sistêmica e doenças comórbidas estão associadas a vários fenótipos na DPOC. É essencial que novas perspectivas sejam desenvolvidas no manejo desta doença.
Correntemente, o CAT tem sido cada vez mais utilizado para avaliar e monitorar a DPOC. Embora vários biomarcadores séricos tenham sido definidos na DPOC, não existe um único biomarcador suficiente e eficaz que possa ser utilizado para avaliar o estado dos pacientes com DPOC. Tem sido demonstrado que os biomarcadores estão associados a vários parâmetros como inflamação, hospitalização e mortalidade.7-13 Entretanto, a relação entre CAT e biomarcadores não tem sido claramente demonstrada. Portanto, o presente estudo tem como objetivo investigar os níveis de inflamação sistêmica na DPOC e determinar a relação entre o CAT e os marcadores inflamatórios e a qualidade de vida.
Materiais e métodosDesenho do estudo
Este foi um estudo observacional transversal de uma única visita. Cento e dez pacientes com DPOC diagnosticados de acordo com os critérios GOLD14 e sessenta e cinco sujeitos de controle foram recrutados entre fevereiro de 2013 e agosto de 2013. Os sujeitos de controle foram escolhidos entre aqueles encaminhados a uma clínica de pneumologia e medicina interna do Hospital Universitário Balikesir, submetidos a investigações de rotina. Foi obtido o consentimento livre e esclarecido por escrito de todos os participantes e o estudo foi aprovado pelo Comitê de Ética Institucional da Faculdade de Medicina da Universidade de Balikesir.
Todos os pacientes foram submetidos a exame físico, radiografia de tórax, teste de função respiratória e análise sanguínea de rotina. Foram registrados o número de exacerbações no ano anterior e a história de tabagismo. O CAT, escore de dispneia mMRC foi realizado através de entrevistas presenciais por especialista pulmonar. Os escores do SGRQ foram relatados pelos pacientes. Para o grupo controle saudável, apenas um teste de função respiratória e testes de análise sanguínea de rotina foram realizados.
A população do estudo
Critérios de inclusão: Foram incluídos os pacientes que (1) tinham mais de 40 anos; (2) eram atuais ou ex-fumantes com histórico de tabagismo ≥10 pack-years; (3) exibiam um VEF1 pós-broncodilatador
80% e um VEF1/CVF0,7. Os sujeitos de controle foram incluídos se eles: (1) tinham mais de 40 anos; (2) estavam livres de doença pulmonar conforme determinado por um médico; (3) tinham espirometria normal (VEF1>85% e VEF1/CVF>0,7); e (4) tinham um histórico de tabagismo
Critérios de exclusão: Foram excluídos os pacientes que: (1) tiveram uma exacerbação da DPOC nas 6 semanas anteriores; (2) tiveram um distúrbio respiratório diferente de DPOC ou malignidade; (3) tiveram uma doença inflamatória crônica (vasculite, doença inflamatória intestinal, artrite reumatóide, etc.).) (4) teve doença não controlada ou concomitante grave (IM, arritmia, etc.).
Medições
Características demográficas, idade, sexo, hábitos tabagistas, admissão em um serviço de emergência ou hospitalização no último ano, doenças acompanhantes, e tratamentos existentes foram todos registrados apropriadamente. Definimos uma exacerbação como agravamento dos sintomas que exigiam corticosteróides orais e/ou antibióticos e/ou internação hospitalar. As doenças comorbitárias foram estabelecidas utilizando a história clínica e os achados do exame físico durante a visita e foram apoiadas por uma revisão dos prontuários médicos disponíveis. Medicações atuais, incluindo inaladores, anti-hipertensivos ou outros medicamentos foram documentados. Os índices de altura, peso e IMC foram medidos e uma espirometria também foi realizada de acordo com as diretrizes internacionais (ATS/ERS).15 A doença foi classificada de acordo com a antiga e a nova versão do estadiamento GOLD.14 Primeiro, o estadiamento espirométrico GOLD (com base no VEF1 (1-4)) e segundo, o estadiamento GOLD (classe A-D). A dispneia foi avaliada pela escala de dispneia mMRC.16 Os pacientes com DPOC foram categorizados em A, B, C e D combinando a avaliação dos sintomas por escores de dispneia mMRC e risco de exacerbação.
CAT: A validade e confiabilidade da versão turca desta escala foi previamente verificada.17 O CAT inclui 8 itens e produz escores totais variando de 0 a 40; escores mais altos indicam um comprometimento do estado de saúde mais grave ou um controle menos bem sucedido da DPOC.3
Quality of life Questionnaire: A qualidade de vida foi avaliada usando a tradução turca do Questionário de Doenças Respiratórias de São Jorge (SGRQ).18
Biomarcadores
Escolhemos os biomarcadores com base em estudos anteriores.7,9-13 As amostras de sangue retiradas de todos os sujeitos foram centrifugadas e armazenadas a -80°C. Todas as amostras foram analisadas quando o estudo foi concluído. O soro foi estudado em um dispositivo diagnóstico (BioTek, ELx 800, EUA) com o uso de kits comerciais (eBioscience, Human TNF-α e Human IL-6 Platinum ELISA, Áustria), e com os métodos de necrose tumoral alfa (TNF-α) e imunoensaio enzimático de nível interleucina-6 (IL-6) (ELISA). Os níveis de proteína C reativa (PCR) foram avaliados com um analisador químico clínico (Cobes Integra 800, diagnóstico Roche) usando um kit comercial. O valor de referência da PCR é de 0-0,5mg/L, enquanto o valor mais baixo analisado de IL-6 é de 0,92pg/ml. O valor mais baixo analisado de TNFα é 2,3pg/ml. As concentrações de TNF-α e IL-6 de algumas amostras estavam abaixo do limite inferior de quantificação (LLQ). Na análise de indivíduos com valores abaixo do LLQ, foi utilizado um nível nominal de metade do valor do LLQ para evitar um viés descendente dos dados populacionais.19
Análise estatística
Os valores médios de PCR dos grupos COPD e controle (3,2 (1,5,7,1), 1,3 (0,6,2,7)) foram identificados a partir de estudos semelhantes.7 Após isso, em cada grupo, o tamanho da amostra foi calculado por meio da fórmula média de cálculo com precisão de 80% e erro de 5%. Assim, o tamanho da amostra foi encontrado em pelo menos 55 sujeitos em cada grupo. Os resultados são apresentados como média±SD, mediana ou porcentagem, conforme o caso. O teste t de Student e a ANOVA foram utilizados para testes paramétricos; o teste U de Mann-Whitney, Kruskal-Wallis e a estatística qui-quadrado foram utilizados para testes não paramétricos para comparações de grupo. O teste exato de Fisher avaliou as diferenças entre as porcentagens de comorbidades e as diferenças entre os sexos. O teste do qui-quadrado avaliou as diferenças entre as porcentagens de comorbidades. A correlação de pares de variáveis contínuas em pacientes com DPOC foi examinada pela correlação de Pearson. Um valor de p
0,05 foi considerado estatisticamente significativo. Todas as análises estatísticas foram realizadas com o software SPSS (versão 20.0). ResultadosCaracterização clínica dos sujeitos
O estudo incluiu 110 pacientes (idade média de 64±8,9 anos; 100 homens (90,9%)), e 65 sujeitos controle (idade média de 61,5±9,2 anos, 55 homens (84,6%)). As características demográficas e clínicas do paciente e dos grupos controle são apresentadas na Tabela 1. Quarenta e cinco (40,9%) pacientes com DPOC tinham uma doença de acompanhamento (cardiopatia isquêmica (n=21), hipertensão arterial (n=13), diabetes mellitus (n=8), outros (n=3)). O VEF1 médio foi de 48,8% do valor previsto e o VEF1/CVF médio: 55,4% no grupo DPOC. O escore CAT médio foi 22,6 (±9,2), mMRC: 1,9 (±0,9) e SGRQ total: 58,4 (±22,2). Dos 110 pacientes, 9,1% estavam no estágio 1, 37,3% no estágio 2, 42,7% no estágio 3, 10,9% no estágio 4 de acordo com o estadiamento espirométrico GOLD. Quando os pacientes foram classificados em relação ao estadiamento OURO, 27,3% eram do grupo A, 30,9% do grupo B, 7,3% do grupo C e 34,5% do grupo D.
Características demográficas, funcionais, clínicas dos grupos paciente e controle.
| Patiente (n=110) | Controlo (n=65) | valor p | |||||
|---|---|---|---|---|---|---|---|
| Idade | 64.0±8.9 | 61.5±9.2 | 0,080 | ||||
| Male n, (%) | 100 (90,9) | 55 (84.6) | 0,224 | ||||
| BMI, kg/m2 | 26,5±5,6 | 25±2,6 | 0.064 | ||||
| Pack-years | 38,9±23 | 0,1±1,2 | |||||
| Co-morbididades, n (%) | |||||||
| Qualquer | 65 (59.1) | 42 (64,6) | 0,95 | ||||
| Doença cardíaca isquémica | 21(19,1) | 11 (16,9) | |||||
| HT | 13 (11.8) | >6 (9.2) | |||||
| DM | 8 (7.3) | 4 (6.2) | |||||
| Outros | 3 (2.7) | >2 (3.1) | |||||
| mMRC | 1.94±0.9 | 0.04±0.2 | |||||
| FEV1, % previsto | 48.8±17.8 | 89,4±5,6 | |||||
| FVC, % previsto | 68,7±17,8 | 92,1±5,8 | |||||
| FEV1/FVC, % previsto | 55.4±12,9 | 89,6±4,7 | |||||
| > | >Estágio espirométrico OURO, n (%) | ||||||
| 1 | 10 (9.1) | ||||||
| 2 | 41 (37.3) | ||||||
| 3 | 47 (42.7) | ||||||
| 4 | 12 (10.9) | ||||||
| GOLD stage, n (%) | |||||||
| A | 30 (27.3) | ||||||
| B | 34 (30.9) | ||||||
| C | 8 (7.3) | ||||||
| D | 38 (34.5) | ||||||
| SGRQ-partitura total | 58,4±22,2 | ||||||
| CAT-partitura total | 22.6±9,2 | ||||||
| TNFα (pg/ml) | 109,5±58 | 14,6±18 | |||||
| IL-6 (pg/ml) | 10.3±18 | 2,14±1,9 | |||||
| CRP (mg/L) | 1,6±1,7 | 0,4±0,3 | |||||
A abreviaturas: IMC, índice de massa corporal, HT: hipertensão arterial, DM: diabetes, VEF1: volume expiratório forçado em 1 segundo, CVF: capacidade vital forçada, CAT: teste de avaliação COPD.
COPD/controle comparativo
Não houve diferença significativa entre as idades (p=0,080, teste t de Student) e os sexos dos dois grupos (p=0,453, teste exato de pescador) (Tabela 1). Os grupos apresentaram comorbidades semelhantes (p=0,095, teste χ2). Como esperado, os pacientes com DPOC apresentaram parâmetros de função pulmonar significativamente menores (VEF1, CVF, VEF1/CVF) em relação aos controles (p
0,001, teste t de Student). Em geral, os pacientes com DPOC apresentaram níveis séricos mais elevados de PCR (1,6±1,7mg/L) e TNF-α (109,5±58pg/ml) e IL-6 (10,3±18pg/ml) do que os controles saudáveis (PCR: 0,4±0,3mg/L, p0,001; TNF-α: 14,6±18pg/ml, p0,001; IL-6: 2,14±1,9pg/ml, p0,001, teste t de Student) (Tabela 1). Associação dos questionários CAT e características dos pacientes
Existiu correlação entre o escore CAT e o estágio espirométrico de GOLD (r de Pearson=0,43; p
0,001). O escore CAT aumentou em paralelo com a gravidade da doença. Houve uma relação estatisticamente significativa entre o escore CAT e o número de exacerbações no ano anterior (r=0,35 de Pearson, p0,001), duração da doença (r=0,29 de Pearson, p0,001), tabagismo (pack-year) (r=0,27 de Pearson, p=0,014) e mMRC (r=0,59 de Pearson, p0,001). O escore CAT foi encontrado significativamente correlacionado com VEF1 (r=-0,39, p0,001) e CVF (r=-42, p=0,003). Ao mesmo tempo, foi observada uma forte correlação entre o escore CAT e o sintoma SGRQ, atividade, impacto e escores totais (r=0,72 de Pearson; p0,001). Associação entre biomarcadores e características dos pacientes
Marcadores inflamatórios e parâmetros de função pulmonar foram comparados. À medida que o VEF1 diminuiu, os níveis de biomarcador aumentaram significativamente. Os níveis de PCR foram correlacionados com o VEF1 (r=-0,39, p
0,001 de Pearson), CVF (r=-0,33, p0,001 de Pearson) e VEF1/CVF (r=-0,38, p0,001 de Pearson). Os níveis de TNF-α também foram correlacionados com FEV1 (Pearson’s r=-0.57, p0.001), FVC (Pearson’s r=-0.37, p0.001) e FEV1/FVC (Pearson’s r=-0.66, p0.001). Os níveis de IL-6 também foram correlacionados com VEF1 (Pearson’s r=-0.31, p0.001), FVC (Pearson’s r=-0.32, p0.001) e FEV1/FVC (Pearson’s r=-0.34, p0.001). Uma correlação significativa foi observada entre CRP, TNF-α, IL-6 e tabagismo (pack-year) (Pearson’s r=0,35, r=0,44, r=0,27, p0,001, respectivamente). Pacientes com DPOC com doença cardiovascular tiveram um nível aumentado de CRP (2,98±2.4mg/L) em comparação com pacientes sem comorbidades (1,56±1,5mg/L, p=0,008 teste ANOVA seguido de teste post-hoc de LSD). Não houve associação significativa com outros biomarcadores e comorbidades. Como a IL-6 aumentou, o escore do mMRC aumentou, mas esta relação não foi estatisticamente significativa (p=0,06). Quando os marcadores inflamatórios foram comparados com o escore CAT, os níveis de PCR mostraram uma correlação significativa (r=0,43, p0,001) (Fig. 1) enquanto não foi observada correlação com TNF-α e IL-6. Houve uma correlação entre os níveis de PCR e TNFα (r=0,48, p0,001). Não foi observada associação direta entre biomarcadores e classe A-D ou estágios espirométricos.
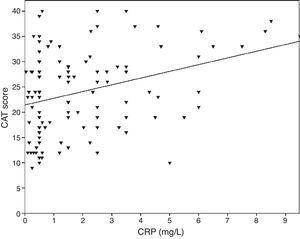
A relação entre os escores CAT e CRP (r=0,43, p0,001).
Discussão
São utilizadas algumas ferramentas de avaliação como testes clínicos (CAT, BODE), marcadores de inflamação e questionários de qualidade de vida para avaliar a DPOC. É comumente aceito que uma avaliação multidimensional é necessária para entender e gerenciar a doença. A DPOC é uma doença complexa com um componente sistêmico e alguns pacientes parecem ter um fenótipo inflamatório. Neste estudo, o CAT foi realizado como um novo teste clínico, e a relação do CAT com outros componentes da DPOC foi investigada.
Um desses componentes é a inflamação sistêmica. Os biomarcadores mais frequentemente estudados na DPOC para indicar inflamação sistêmica que são comumente usados são CRP, IL-6, TNF-α, IL-8 e fibrinogênio. Vários estudos relataram anteriormente níveis elevados desses marcadores em pacientes com DPOC estável.6-9,20-23 Em estudo recente, Agustí et al. mostraram que 30% dos pacientes com DPOC não apresentavam evidência de inflamação sistêmica e 16% dos pacientes apresentavam inflamação sistêmica persistente.7 Curiosamente, neste estudo, os níveis séricos de TNF-α e IL-8 foram encontrados em fumantes com espirometria normal em comparação aos pacientes com DPOC. Os outros marcadores como glóbulos brancos, IL-6, PCR e fibrinogênio foram encontrados em pacientes com DPOC mais elevados do que nos fumantes com espirometria normal e não-fumantes. Em nosso estudo, os níveis de CRP, TNF-α, IL-6 foram significativamente mais altos em todos os pacientes com DPOC quando comparados ao grupo controle. Todos os biomarcadores foram correlacionados com a exposição cumulativa ao tabagismo e redução dos parâmetros do teste de função pulmonar (VEF1, CVF e VEF1/CVF). O nível dos biomarcadores relaciona-se com o grau de obstrução do fluxo aéreo. Esses resultados são consistentes com os relatados em estudos transversais anteriores.13 Em outro estudo que examinou os resultados do ECLIPSE, comorbidades cardiovasculares e diabetes foram correlacionados com alguns marcadores de inflamação sistêmica.9 Em nosso estudo, pacientes com DPOC com doença cardiovascular tiveram um aumento do nível de PCR comparado a pacientes sem comorbidades. O aumento da inflamação sistêmica em DPOC com doenças cardiovasculares suporta um mecanismo fisiopatológico entre DPOC e essas comorbidades.
A relação entre CAT e inflamação sistêmica não foi esclarecida pelos estudos realizados até o momento. Em um estudo, uma correlação significativa foi mostrada entre o LCN1, LCN2 e CAT.8 Em nosso estudo, uma relação significativa foi mostrada entre o CAT e a PCR. No entanto, uma correlação semelhante não pôde ser mostrada com TNF-α e IL-6,
No presente estudo, os pacientes com DPOC foram categorizados em quatro grupos (A-D) e estágios (1-4) de acordo com a antiga e nova versão da classificação GOLD. Pode-se observar que os estágios 1 e 4 constituem a menor proporção da população com 10% cada um, de acordo com a classificação antiga. Na nova versão, a população foi distribuída quase igualmente entre os grupos A, B e D; a menor distribuição foi a do grupo C. Em outros estudos, também foi demonstrado que o grupo C constitui a menor proporção da distribuição.24,25 A nova classificação indica que pode haver alguns pacientes com sintomas múltiplos mas com obstrução leve das vias aéreas, assim como alguns pacientes com poucos sintomas mas com obstruções graves das vias aéreas. Comorbidades e inflamação sistêmica podem levar a aumentos na exacerbação e sintomas em pacientes com obstrução leve/moderada e, dessa forma, faz com que esses pacientes sejam colocados nos grupos de alto risco (classe C ou D). Em um estudo, foi demonstrado que o subtipo C inclui pacientes com maior comorbidade e o subtipo D inclui pacientes com exacerbação mais grave, alta taxa de exacerbação relacionada à hospitalização e resultados mais pobres.26 Em um estudo recente, Agustí et al. compararam dois grupos com e sem inflamação sistêmica persistente e mostraram que pacientes que apresentavam inflamação persistente durante o acompanhamento tinham taxas de exacerbação maiores por ano em comparação com o outro grupo, embora anormalidades pulmonares fossem semelhantes nesses dois grupos.7
GOLD recomendam o uso da escala CAT ou mMRC para avaliar os sintomas. Utilizamos a escala mMRC para a atribuição dos grupos, pois quando consideramos os sintomas com base no CAT, o número de pacientes com menos de 10 pontos de parada foi muito pequeno (8 pacientes). Os escores mais altos de EAC podem estar associados com as maiores percepções dos sintomas dos pacientes. Também foi demonstrado que EAC e MMRC não são equivalentes, o que pode causar algumas diferenças na classificação.24,25,27 Na nova classificação, os outros pontos de corte são compostos de número de exacerbações por ano. A relação entre a pontuação basal da EAC e a frequência das exacerbações foi mostrada nos pacientes com DPOC.28 Pothirat et al. mostraram que a mudança na pontuação da EAC durante as visitas de monitoramento é uma ferramenta útil para detectar a deterioração aguda do estado de saúde dos pacientes com DPOC.29 Em nosso estudo, foi observada uma forte relação entre a EAC, o mMRC e as taxas de exacerbação. A EAC também foi encontrada correlacionada com a duração da doença, e o tabagismo (pack-year). O VEF1 médio dos pacientes foi de 48,8% do valor previsto e o escore CAT médio foi de 22,6. Uma forte associação entre CAT e VEF1, CVF e o estágio espirométrico do OURO foi mostrada. Como o VEF1 e a CVF diminuíram, o escore CAT aumentou. O escore CAT também se correlacionou positivamente com um estágio mais pesado de OURO. Estes resultados mostram que o CAT reflete muito bem a gravidade da doença.
Outro componente importante da gestão da DPOC é a qualidade de vida. Uma variedade de questionários de vida tem sido usada para avaliar os efeitos da doença na vida diária. A confiabilidade e validade da versão turca do SGRQ foi provada.30 Alguns estudos mostraram que foi observada uma correlação significativa entre CAT e SGRQ.3,4 Em um estudo, foi relatado que CAT é sensível à mudança no estado de saúde associada com exacerbações da DPOC.31 Em nosso estudo, foi mostrada uma forte relação entre CAT e SGRQ. Como o CAT, comparado ao SGRQ, é um teste mais curto e fácil de entender, o uso do CAT é mais prático.
O presente estudo tem várias limitações, tais como o desenho transversal, um único estudo central e o tamanho da amostra pequena. Além disso, os marcadores de inflamação não puderam ser comparados em fumantes que têm função pulmonar normal, pois não foram incluídos no presente estudo. Os medicamentos para os pacientes podem exercer influência na resposta inflamatória sistêmica e no estado de saúde e também podem afetar os resultados.
Em resumo, o CAT é um teste que pode ser usado na avaliação da DPOC, uma vez que sua confiabilidade e validade foram claramente demonstradas. Os resultados do nosso estudo indicam a relação entre CAT e PCR, assim como outros componentes da DPOC (parâmetros clínicos, funcionais). Entretanto, estudos longitudinais multicêntricos são necessários para avaliar a relação entre CAT e biomarcadores.
Divulgações éticasProteção de sujeitos humanos e animais
Os autores declaram que nenhum experimento foi realizado em humanos ou animais para este estudo.
Confidencialidade dos dados
Os autores declaram ter seguido os protocolos de seu centro de trabalho na publicação dos dados dos pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram seu consentimento livre e esclarecido por escrito para participar do estudo.
Direito à privacidade e consentimento livre e esclarecido
Os autores obtiveram o consentimento livre e esclarecido por escrito dos pacientes ou sujeitos mencionados no artigo. O autor correspondente está de posse deste documento.
Authorship
Study design: NS, FE e AAH; Coleta de dados: NS, CB; Análise e interpretação dos dados: NS, AAH, e CB; Revisão crítica do manuscrito: NS, FE, CB e AAH.
Conflitos de interesse
Os autores declaram não ter conflito de interesse na preparação deste manuscrito.
