US Pharm. 2020;45(5)(Specialty&Oncology suppl):3-8.
ABSTRACT: Nos últimos anos, várias novas opções terapêuticas específicas foram desenvolvidas para combater a resistência à terapia endócrina tradicional para o câncer de mama avançado. Três inibidores CDK4/6 (palbociclib, ribociclib e abemaciclib) foram aprovados para pacientes com receptor hormonal positivo, receptor do fator de crescimento epidérmico humano 2-negativo para câncer de mama avançado. Cada agente demonstrou sua eficácia, mas existem diferenças entre os três medicamentos, particularmente em seus perfis de eventos adversos.
O câncer de mama é o tipo mais comum de câncer em mulheres, com mais de 276.000 novos casos estimados em 2020.1 O câncer de mama receptor-hormônio positivo (FC+), que responde por mais de 70% desses casos, tem sido historicamente tratado com terapia endócrina (ET), como inibidores seletivos do receptor de estrogênio e inibidores da aromatase (IAs). Embora a ET continue sendo a espinha dorsal do tratamento do câncer de mama FC+, a resistência se desenvolve em até 50% das pacientes com câncer de mama avançado.2 Para combater a resistência, foram aprovadas terapias específicas para o câncer de mama FC+.3,4
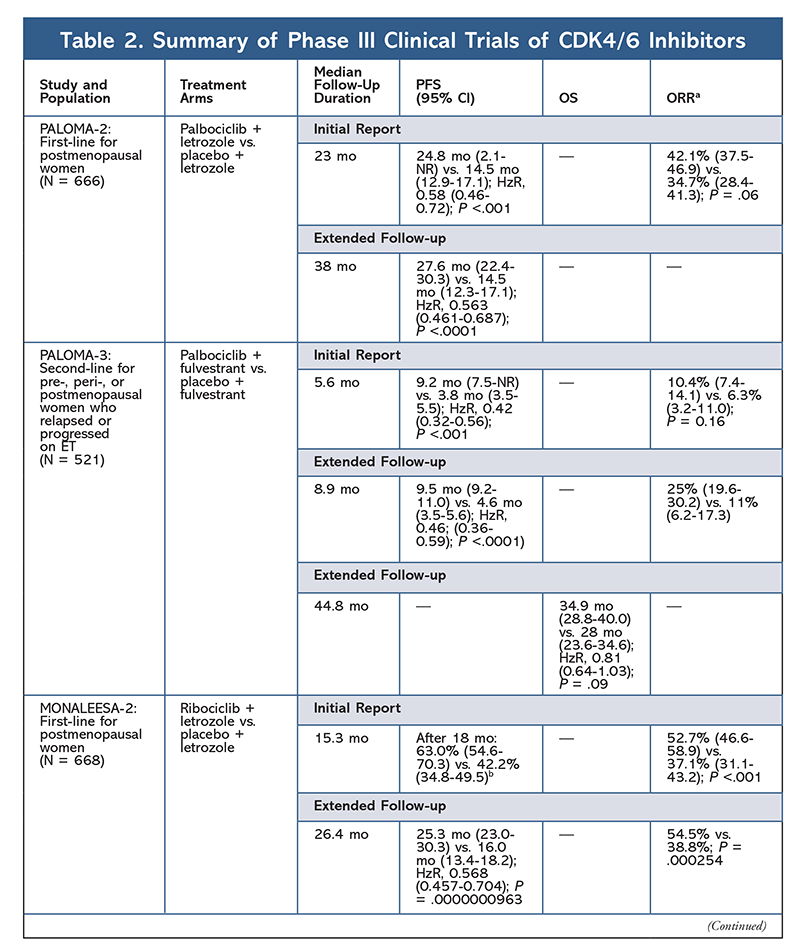
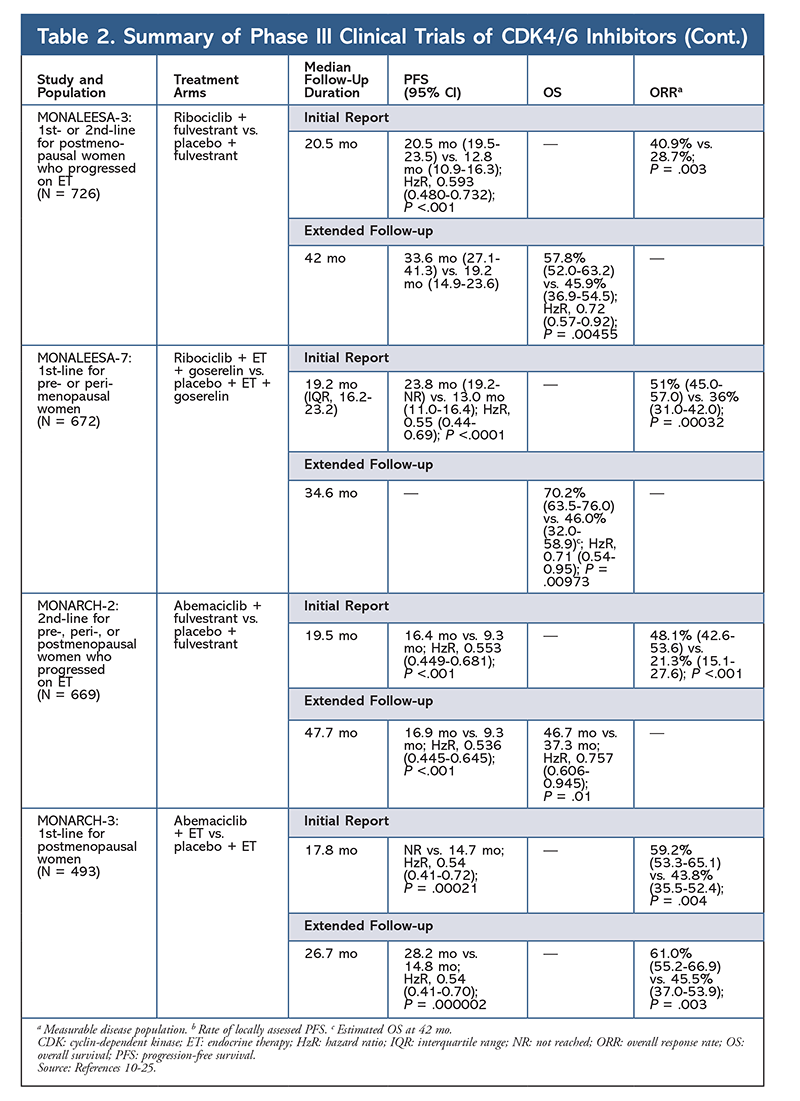
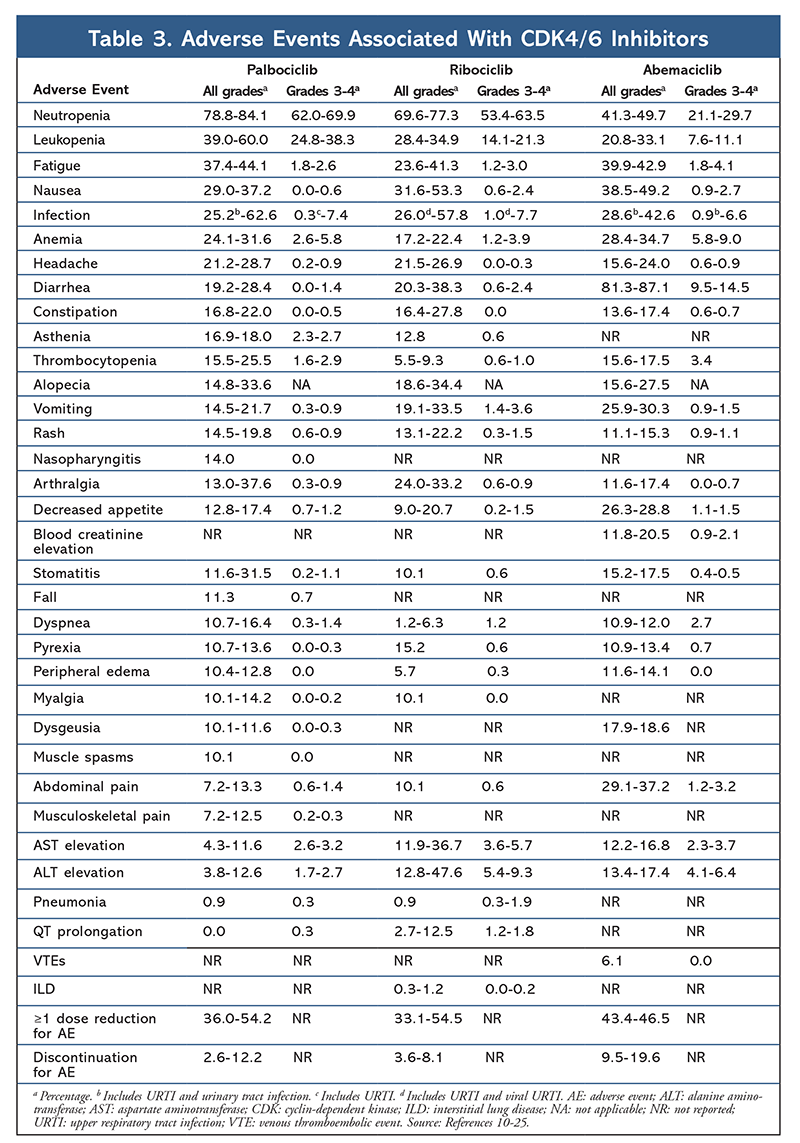
Inibidores da cinase dependente de ciclina (CDK), a mais nova classe de interesse para o câncer de mama avançado, funcionam inibindo especificamente as proteínas CDK4/6 e bloqueando a transição da fase G1 para a fase S do ciclo celular. Esta classe de medicamentos inibe a atividade cinase, que fosforila o caminho da proteína retinoblastoma. Bloqueando este caminho, os inibidores CDK4/6 são capazes de bloquear a progressão do ciclo celular no meio da fase G1 e impedir a progressão das células cancerígenas. Nos últimos anos, três inibidores CDK4/6 (palbociclib, ribociclib e abemaciclib) foram aprovados como terapias combinadas para HR+, receptor 2-negativo do fator de crescimento epidérmico humano (HER2-), câncer de mama avançado ou metastático.5-8 Este artigo revisa as diferenças desses agentes (TABELA 1), a fase III dos ensaios clínicos (TABELA 2) e os perfis dos eventos adversos (EA) (TABELA 3).
Palbociclib
Em 2015, o palbociclib tornou-se o primeiro inibidor CDK4/6 a receber a aprovação da FDA para o tratamento do FC+, HER2- cancro da mama (em combinação com uma IA como ET inicial em mulheres na pós-menopausa ou em homens, ou em combinação com fulvestrante em pacientes com progressão da doença após a ET).6,9-14 O palbociclibe recebeu inicialmente aprovação após resultados positivos do estudo fase II PALOMA-1, que comparou palbociclibe mais letrozol com letrozol sozinho como terapia inicial para pacientes com cancro da mama com ET avançada.9
Estes resultados levaram a dois ensaios fase III que avaliaram melhor o efeito do palbociclib nesta população de doentes. Os resultados iniciais do PALOMA-2 confirmaram os efeitos do palbociclibe mais letrozol, demonstrando uma melhor sobrevida sem progressão (PFS) versus letrozol sozinho (24,8 mo vs. 14,5 mo, respectivamente; relação de perigo para progressão da doença ou morte, 0,58; IC 95%, 0,46-0,72; P <,001). Um estudo de seguimento a longo prazo aos 38 meses confirmou ainda mais o efeito do palbociclib sobre a PFS, com um aumento para 27,6 meses versus 14,5 meses para o letrozol sozinho (HzR, 0,563; IC 95%, 0,461-0,687; P <,0001). O estudo de acompanhamento também relatou melhora consistente da PFS com palbociclib mais letrozol em todos os subgrupos estudados, bem como atraso no tempo médio de início da terapia subsequente. Entretanto, os dados de sobrevida global (SO) para os relatórios inicial e de acompanhamento foram imaturos, e as pacientes inscritas estão sendo seguidas para sobrevivência.10,11
Pouco depois do início do PALOMA-2, outro estudo fase III, PALOMA-3, foi iniciado para avaliar a segurança e eficácia do palbociclibe mais fulvestrante em mulheres com câncer de mama avançado de FC+ na pré-menopausa ou pós-menopausa que progrediram no ET anterior. O relatório inicial após 5,6 meses de seguimento mostrou uma melhora na mediana da SAF (9,2 mo vs. 3,8 mo), com uma redução de 58% na progressão (HzR, 0,42; 95% CI, 0,32-0,56; P <,001).12 Uma análise pré-especificada da SAF no ensaio PALOMA-3, usando um seguimento mediano de 44.Em 8 meses, verificou-se que as diferenças de OS para todo o grupo de intenção de tratamento não alcançaram significância estatística, mas a combinação prolongou OS por 10 meses em pacientes sensíveis a ET prévia.14
O perfil da EA permaneceu consistente em todos os relatos de estudo (TABELA 3), sendo a neutropenia de todos os graus (78,8%-84,1%), leucopenia (39%-60%) e fadiga (37,4%-44,1%) as EA mais frequentemente relatadas. As taxas de neutropenia foram altas, porém, a neutropenia febril foi rara (até 2%). A tolerabilidade geral do palbociclibe foi considerada controlável, e o agente resultou em dados positivos de qualidade de vida quando usado em terapia combinada em comparação com monoterapia endócrina.9,14
Ribociclibe
Um segundo inibidor CDK4/6, ribociclibe, foi aprovado pelo FDA em 2017, com uma população de pacientes indicada mais ampla. O ribociclibe é aprovado para mulheres pós-menopausadas e pré ou perimenopausadas com FC+, HER2- avançado ou câncer de mama metastático (como terapia combinada com uma IA como ET inicial ou, em mulheres pós-menopausadas, combinado com fulvestrant como ET inicial ou após a progressão da doença no ET).7
Ribociclib recebeu a primeira aprovação do FDA após o ensaio MONALEESA-2 ter constatado que o PFS foi melhorado quando o medicamento foi administrado em combinação com letrozol versus letrozol sozinho. As taxas de PFS avaliadas localmente versus letrozol sozinho após 18 meses foram de 63,0% (IC 95%, 54,6-70,3) e 42,2% (IC 95%, 34,8-49,5), respectivamente.15 Um relatório de acompanhamento prolongado aos 26,4 meses demonstrou ainda mais a eficácia e tolerabilidade da combinação.16 Apesar da melhora na PFS, os dados de OS para MONALEESA-2 permanecem imaturos.
Ribociclib também está sendo investigado (em MONALEESA-3) em combinação com Fulvestrant em pacientes com tratamento – ingênuo e aqueles que recaíram após a ET. O relatório inicial revelou melhora da PFS para a combinação em relação ao fulvestrante sozinho (20,5 mo vs. 12,8 mo, respectivamente; HzR, 0,593; IC 95%, 0,480-0,732; P <,001), o que resultou na aprovação desta combinação pelo FDA.17 Um segundo relatório, e o mais recente, CDK4/6 inibidor, que teve 21,6 meses adicionais de acompanhamento, demonstrou ainda mais a melhora consistente da PFS. Este relatório também comprovou o benefício da OS do ribociclib plus fulvestrant em relação ao fulvestrant sozinho, com uma OS estimada em 42 meses de 57,8% versus 45,9%, respectivamente, e uma redução de 28% no risco relativo de morte (HzR, 0,72; 95% CI, 0,57-0.92; P = .00455).18
Um terceiro ensaio clínico, MONALEESA-7, é atualmente o único ensaio de fase III para avaliar a eficácia e segurança de um inibidor CDK4/6 como terapia de primeira linha para mulheres pré ou perimenopausadas que apresentam câncer de mama metastático. Neste estudo, o ribociclibe mais tamoxifeno ou uma IA não esteróide (AINE) – como o letrozol ou a anastrozol-plus goserelina – melhorou significativamente a PFS em 23,8 meses versus 13 meses para o grupo placebo (HzR, 0,55; 95% CI, 0,44-0,69; P <,0001), e a combinação levou à indicação expandida que inclui mulheres pré e perimenopausais.19 Um relatório de acompanhamento prolongado demonstrou o benefício da OS da combinação ribociclib plus tamoxifen ou um AINE plus goserelin em relação ao placebo, com uma OS estimada em 42 meses de 70,2% versus 46,0%.20
O perfil de toxicidade para ribociclib é altamente similar ao do palbociclib, sendo a neutropenia e a leucopenia as EAs de grau mais alto e severo (graus 3/4) relatadas, embora com taxas mais baixas do que para palbociclib (TABELA 3).15-20 A neutropenia febril foi rara, e não surgiram novas preocupações de segurança com maior exposição ao ribociclibe em nenhum dos relatórios de acompanhamento prolongado.
Abemaciclib
O terceiro inibidor CDK4/6 a ser aprovado pelo FDA é o abemaciclib. Este agente é indicado em combinação com uma IA como ET inicial em mulheres pós-menopausadas com câncer de mama avançado, ou em combinação com Fulvestrant em mulheres pré, peri-, ou pós-menopausadas com progressão da doença após a ET. O abemaciclibe também é aprovado como monoterapia em homens e mulheres com progressão da doença após o ET e quimioterapia prévia no cenário metastático.6 O agente inicialmente obteve aprovação com base nos resultados do MONARCH-1 demonstrando atividade clínica promissora após 12 meses, com uma taxa de resposta global (ORR) de 19,7% (IC 95%, 13,3-27,5) e uma PFS mediana de 6 meses.5,21 Durante esse tempo, o abemaciclibe também estava sendo investigado no MONARCH-2 para mulheres em pré, peri- e pós-menopausa que progrediram no ET. Este estudo demonstrou benefício estatisticamente significativo do PFS com uma combinação de abemaciclib mais fulvestrante versus fulvestrante isoladamente (16,4 mo vs. 9,3 mo; HzR, 0,553; IC 95%, 0,449-0,681; P <,001).22 Um estudo de seguimento prolongado com duração mediana de 47.7 meses reportaram ligeira melhora nos resultados de PFS e benefício OS com a combinação abemaciclib versus placebo versus fulvestrant (46,7 mo vs. 37,3 mo; IC 95%, 0,606-0,945; P = .01).23
Curto após o início dos dois ensaios de abemaciclib, foi iniciado o MONARCH-3. Este ensaio encontrou uma melhoria estatisticamente significativa no PFS e ORR com abemaciclib mais um AINE em comparação com o braço placebo-plus-NSAI como tratamento de primeira linha para mulheres na pós-menopausa. Um relatório atualizado com 8,9 meses de acompanhamento adicional confirmou os resultados da análise inicial do PFS e ORR; entretanto, os dados do OS permanecem imaturos, e a análise final do OS será realizada após 315 eventos.24,25
Overall, o abemaciclib tem sido notado como o inibidor mais potente do CDK4/6, com excelente atividade do sistema nervoso central devido à sua estrutura, permitindo que ele atravesse a barreira hematoencefálica e permaneça no alvo por mais tempo.5 Isto pode ser benéfico para pacientes com metástases cerebrais. Embora o abemaciclibe também tenha altas porcentagens de EAs hematológicas, essas taxas são muito mais baixas do que as de outros inibidores CDK4/6. O abemaciclibe está associado a mais toxicidade gastrointestinal, como a diarréia, do que outros inibidores CDK4/6 (todos os graus: 81,3%-87,1%; graus 3-4: 9,5%-14,5%).22-25
O papel do farmacêutico
Overtudo, os perfis de EA dos vários inibidores CDK 4/6 são semelhantes, mas cada medicamento tem EA únicos. As EAs mais comuns relatadas com inibidores CDK4/6 são neutropenia, leucopenia, fadiga, náusea, infecção, artralgia, anemia, dor de cabeça e diarréia (TABELA 3). Além da neutropenia e leucopenia, a maioria dos pacientes relatou EAs de grau 1 ou 2. A neutropenia e leucopenia de grau 3 ou 4, que eram muito comuns com todos os inibidores CDK, particularmente palbociclib e ribociclib, foram tratadas principalmente com interrupção e/ou redução da dose. O hemograma do paciente deve ser monitorado na linha de base, a cada 2 semanas durante os dois primeiros ciclos, no início de cada quatro ciclos subsequentes, e como clinicamente necessário para a supressão da medula óssea.6-8 Quedas, espasmos musculares e nasofaringite estão associados ao palbociclib, mas são leves na maioria dos casos.10,11,14 Uma baixa incidência de prolongamento do QT tem sido relatada com ribociclib.15-20 Abemaciclib foi associada a uma incidência significativamente maior de diarréia em comparação com palbociclib e ribociclib; os casos ocorreram principalmente durante o primeiro ciclo e puderam ser tratados com terapia antidiarréica.22-25 O abemaciclibe foi associado à elevação da creatinina sérica e a eventos tromboembólicos venosos (em sua maioria leves), que não foram relatados para palbociclibe e ribociclibe, e a uma maior incidência de dor abdominal.22-25 Notadamente, em setembro de 2019, a FDA advertiu que doenças pulmonares intersticiais (DPI) e pneumonites podem ocorrer em pacientes tratados com inibidores CDK4/6, raras mas graves, com risco de vida ou fatais.26 Portanto, os pacientes devem ser monitorados regularmente para sintomas pulmonares indicativos de DPI e/ou pneumonite.
Conclusão
As aprovações de palbociclib, ribociclib e abemaciclib nos últimos anos expandiram as opções de tratamento para pacientes com câncer de mama avançado. Embora todos eles possuam o mesmo mecanismo de acção, estes medicamentos apresentam ligeiras diferenças em termos de eficácia e segurança. Vários estudos em curso, além dos mencionados nesta revisão, continuam a explorar estes inibidores em diferentes populações de pacientes e com diferentes combinações de tratamento. O potencial destes agentes para expandir o uso de inibidores CDK4/6 em outros ambientes que não a FC+, HER2- câncer de mama avançado parece promissor.27
1. Siegel RL, Miller KD, Jemal A. Estatísticas de câncer, 2020. CA Câncer J Clin. 2020;70(1):7-30.
2. Preusser M, De Mattos-Arruda L, Thill M, et al. CDK4/6 inibidores no tratamento de pacientes com câncer de mama: resumo de uma discussão multidisciplinar em mesa redonda. ESMO Aberto. 2018;3(5):e000368.
3. Tripathy D, Bardia A, Sellers WR. Ribociclib (LEE011): mecanismo de ação e impacto clínico deste inibidor seletivo da quinase dependente da ciclina 4/6 em vários tumores sólidos. Clin Cancer Res. 2017;23(13):3251-3262.
4. Portman N, Alexandrou S, Carson E, et al. Overcoming CDK4/6 inhibitor resistance in ER-positive breast cancer. Endocr Relat Cancer. 2019;26(1):R15-R30.
5. Sobhani N, D’Angelo A, Pittacolo M, et al. Atualizações sobre a estratégia inibitória CDK4/6 e combinações no câncer de mama. Células. 2019;8(4):E321.
6. Ibrance (palbociclib) bula. Nova Iorque, NY: Pfizer Inc; Setembro 2019.
7. Inserção da embalagem de Kisqali (ribociclib). East Hanover, NJ: Novartis Pharmaceuticals Corp; Setembro de 2019.
8. Indianapolis, IN: Eli Lilly and Co; Setembro de 2019.
9. Finn RS, Crown JP, Lang I, et al. O inibidor da ciclina quinase 4/6 palbociclib em combinação com letrozol versus letrozol sozinho como tratamento de primeira linha de estrogênio receptor-positivo, HER2-negativo, câncer de mama avançado (PALOMA-1/TRIO-18): um estudo randomizado de fase 2. Lancet Oncol. 2015;16(1):25-35.
10. Finn RS, Martin M, Rugo HS, et al. Palbociclib e letrozole em câncer de mama avançado. N Engl J Med. 2016;375(20):1925-1936.
11. Rugo HS, Finn RS, Diéras V, et al. Palbociclib plus letrozole como terapia de primeira linha no receptor de estrogênio – receptor de fator de crescimento epidérmico 2-negativo – câncer de mama avançado com seguimento prolongado. Tratamento de Res do câncer de mama. 2019;174(3):719-729.
12. Turner NC, Ro J, André F, et al. Palbociclib em câncer de mama avançado hormonal-receptor-positivo. N Engl J Med. 2015;373(3):209-219.
13. Cristofanilli M, Turner NC, Bondarenko I, et al. Fulvestrant plus palbociclib versus fulvestrant plus placebo para tratamento de câncer de mama hormonal-receptor-positivo, HER2-negativo metastático que progrediu na terapia endócrina anterior (PALOMA-3): análise final do estudo controlado multicêntrico, duplo-cego, fase 3 randomizado. Lancet Oncol. 2016;17(4):425-439.
14. Turner NC, Slamon DJ, Ro J, et al. Sobrevivência geral com palbociclib e fulvestrant em câncer de mama avançado. N Engl J Med. 2018;379(20):1926-1936.
15. Hortobagyi GN, Stemmer SM, Burris HA, et al. Ribociclib como terapia de primeira linha para o câncer de mama avançado e positivo para a FC. N Engl J Med. 2016;375(18):1738-1748.
16. Hortobagyi GN, Stemmer SM, Burris HA, et al. Updated results from MONALEESA-2, a phase III trial of first-line ribociclib plus letrozole versus placebo plus letrozole in hormone receptor-positivo, HER2-negativo, câncer de mama avançado. Ann Oncol. 2018;29(7):1541-1547.
17. Slamon DJ, Neven P, Chia S, et al. Estudo randomizado fase III de ribociclib e fulvestrant em receptor hormonal positivo, receptor epidérmico humano receptor 2-negativo câncer de mama avançado: MONALEESA-3. J Clin Oncol. 2018;36(24):2465-2472.
18. Slamon DJ, Neven P, Chia S, et al. Sobrevivência geral com ribociclib mais fulvestrant em câncer de mama avançado. N Engl J Med. 2020;382(6):514-524.
19. Tripathy D, Im SA, Colleoni M, et al. Ribociclib plus terapia endócrina para mulheres pré-menopausadas com câncer de mama hormonal positivo e avançado (MONALEESA-7): um ensaio aleatório, fase 3. Lancet Oncol. 2018;19(7):904-915.
20. Im SA, Lu YS, Bardia A, et al. Sobrevivência global com ribociclib mais terapia endócrina no cancro da mama. N Engl J Med. 2019;381(4):307-316.
21. Dickler MN, Tolaney SM, Rugo HS, et al. MONARCH 1, um estudo fase II de abemaciclib, um inibidor CDK4 e CDK6, como agente único, em pacientes com câncer de mama refractário HR+/HER2- metastático. Clin Cancer Res. 2017;23(17):5218-5224.
22. Sledge GW Jr, Toi M, Neven P, et al. MONARCH 2: abemaciclib em combinação com fulvestrant em mulheres com FC+/HER2- câncer de mama avançado que tinham progredido enquanto recebiam terapia endócrina. J Clin Oncol. 2017;35(25):2875-2884.
23. Sledge GW Jr, Toi M, Neven P, et al. The effect of abemaciclib plus fulvestrant on overall survival in hormone receptor-positive, ERBB2-negative breast cancer that progressed on endocrine therapy-MONARCH 2: a randomized clinical trial. JAMA Oncol. 2020;6(1):116-124.
24. Goetz MP, Toi M, Campone M, et al. MONARCH 3: abemaciclib como terapia inicial para o câncer de mama avançado. J Clin Oncol. 2017;35(32):3638-3646.
25. Johnston S, Martin M, Di Leo A, et al. MONARCH 3 final PFS: a randomized study of abemaciclib as initial therapy for advanced breast cancer. NPJ Câncer de Mama. 2019;17(5):5.
26. FDA. FDA adverte sobre inflamação pulmonar rara mas grave com Ibrance, Kisqali, e Verzenio para câncer de mama. www.fda.gov/drugs/drug-safety-and-availability/fda-warns-about-rare-severe-lung-inflammation-ibrance-kisqali-and-verzenio-breast-cancer. Acesso em 15 de janeiro de 2020.
27. Shah M, Nunes MR, Stearns V. Inibidores CDK4/6: modificadores de jogo no manejo do câncer de mama avançado receptor hormonal-positivo? Oncologia (Williston Park). 2018;32(5):216-222.
O conteúdo deste artigo é apenas para fins informativos. O conteúdo não pretende ser um substituto para o aconselhamento profissional. A confiança em qualquer informação fornecida neste artigo é apenas por sua conta e risco.
