US Pharm. 2020;45(5)(Specialty&Oncology suppl):3-8.
ABSTRACT: În ultimii ani, au fost dezvoltate mai multe opțiuni noi de terapie țintită pentru a combate rezistența la terapia endocrină tradițională pentru cancerul de sân avansat. Trei inhibitori CDK4/6 (palbociclib, ribociclib și abemaciclib) au fost aprobați pentru pacientele cu cancer de sân avansat cu receptori hormonali pozitivi, receptor al factorului de creștere epidermal uman 2 negativ. Fiecare agent și-a demonstrat eficacitatea, dar există diferențe între cele trei medicamente, în special în ceea ce privește profilul lor de evenimente adverse.
Cancerul de sân este cel mai frecvent tip de cancer la femei, cu peste 276.000 de cazuri noi estimate în 2020.1 Cancerul de sân cu receptori hormonali pozitivi (HR+), care reprezintă peste 70% din aceste cazuri, a fost tratat în mod istoric cu terapie endocrină (ET), cum ar fi inhibitorii selectivi ai receptorilor de estrogen și inhibitorii de aromatază (IA). Deși ET rămâne coloana vertebrală a tratamentului cancerului de sân HR+, rezistența se dezvoltă la până la 50% dintre pacientele cu cancer de sân avansat.2 Pentru a combate rezistența, au fost aprobate terapii țintite pentru cancerul de sân HR+.3,4
Inhibitorii de kinază dependentă de ciclină (CDK), cea mai nouă clasă de interes pentru cancerul de sân avansat, acționează prin inhibarea specifică a proteinelor CDK4/6 și prin blocarea tranziției de la faza G1 la faza S a ciclului celular. Această clasă de medicamente inhibă activitatea kinazei, care fosforilează calea proteică a retinoblastomului. Prin blocarea acestei căi, inhibitorii CDK4/6 sunt capabili să blocheze progresia ciclului celular în mijlocul fazei G1 și să împiedice progresia celulelor canceroase. În ultimii ani, trei inhibitori CDK4/6 (palbociclib, ribociclib și abemaciclib) au fost aprobați ca terapii combinate pentru cancerele de sân avansate sau metastatice HR+, cu receptorul 2 negativ al factorului de creștere epidermal uman (HER2-).5-8 Acest articol trece în revistă diferențele dintre acești agenți (TABELUL 1), studiile clinice de fază III (TABELUL 2) și profilul evenimentelor adverse (AE) (TABELUL 3).
Palbociclib
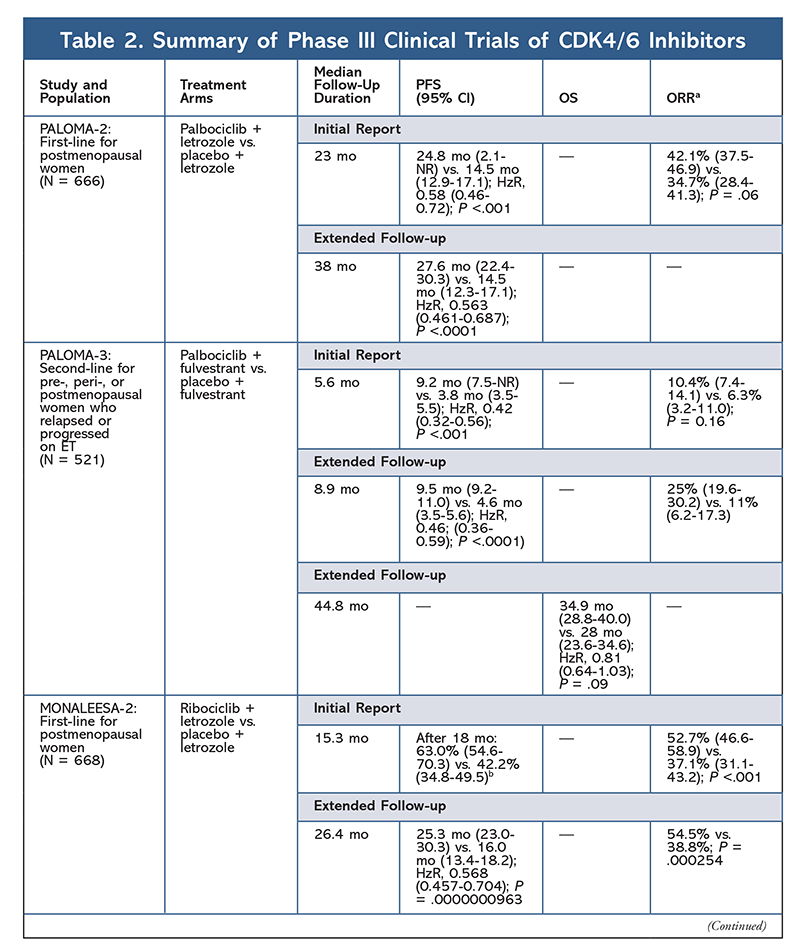
În 2015, palbociclib a devenit primul inhibitor CDK4/6 care a primit aprobarea FDA pentru tratamentul cancerului de sân HR+, HER2- (în asociere cu un AI ca ET inițial la femeile aflate în postmenopauză sau la bărbați, sau în asociere cu fulvestrant la pacientele cu progresie a bolii după ET).6,9-14 Palbociclib a primit inițial aprobarea după rezultatele pozitive ale studiului de fază II PALOMA-1, care a comparat palbociclib plus letrozol cu letrozol singur ca tratament inițial pentru pacientele cu cancer de sân avansat naive de ET9.
Aceste rezultate au condus la două studii de fază III care au evaluat în continuare efectul palbociclibului la această populație de paciente. Rezultatele inițiale ale studiului PALOMA-2 au confirmat efectele palbociclib plus letrozol, demonstrând o supraviețuire fără progresie (PFS) îmbunătățită față de letrozol singur (24,8 luni vs. 14,5 luni, respectiv; raportul de risc pentru progresia bolii sau deces, 0,58; 95% CI, 0,46-0,72; P <.001). Un studiu de urmărire pe termen lung la 38 de luni a confirmat și mai mult efectul palbociclibului asupra SFP, cu o creștere la 27,6 luni față de 14,5 luni pentru letrozol singur (HzR, 0,563; IC 95%, 0,461-0,687; P <.0001). Studiul de urmărire a raportat, de asemenea, o îmbunătățire consistentă a SFP cu palbociclib plus letrozol în toate subgrupurile studiate, precum și o întârziere a timpului median până la inițierea unui tratament ulterior. Cu toate acestea, datele privind supraviețuirea globală (OS) pentru raportul inițial și cel de urmărire au fost imature, iar pacientele înrolate sunt urmărite pentru supraviețuire.10,11
La scurt timp după începerea studiului PALOMA-2, a fost demarat un alt studiu de fază III, PALOMA-3, pentru a evalua siguranța și eficacitatea palbociclibului plus fulvestrant la femeile aflate în premenopauză sau postmenopauză cu cancer de sân avansat HR+ care a progresat la tratamentul anterior cu ET. Raportul inițial, după 5,6 luni de urmărire, a arătat o îmbunătățire a SSP mediană (9,2 luni față de 3,8 luni), cu o reducere cu 58% a progresiei (HzR, 0,42; 95% CI, 0,32-0,56; P <.001).12 O analiză prespecificată a SG în cadrul studiului PALOMA-3, utilizând o urmărire mediană de 44.8 luni, a constatat că diferențele în ceea ce privește OS pentru întregul grup de intenție de tratament nu au atins semnificația statistică, dar combinația a prelungit OS cu 10 luni la pacienții care au fost sensibili la ET anterioară.14
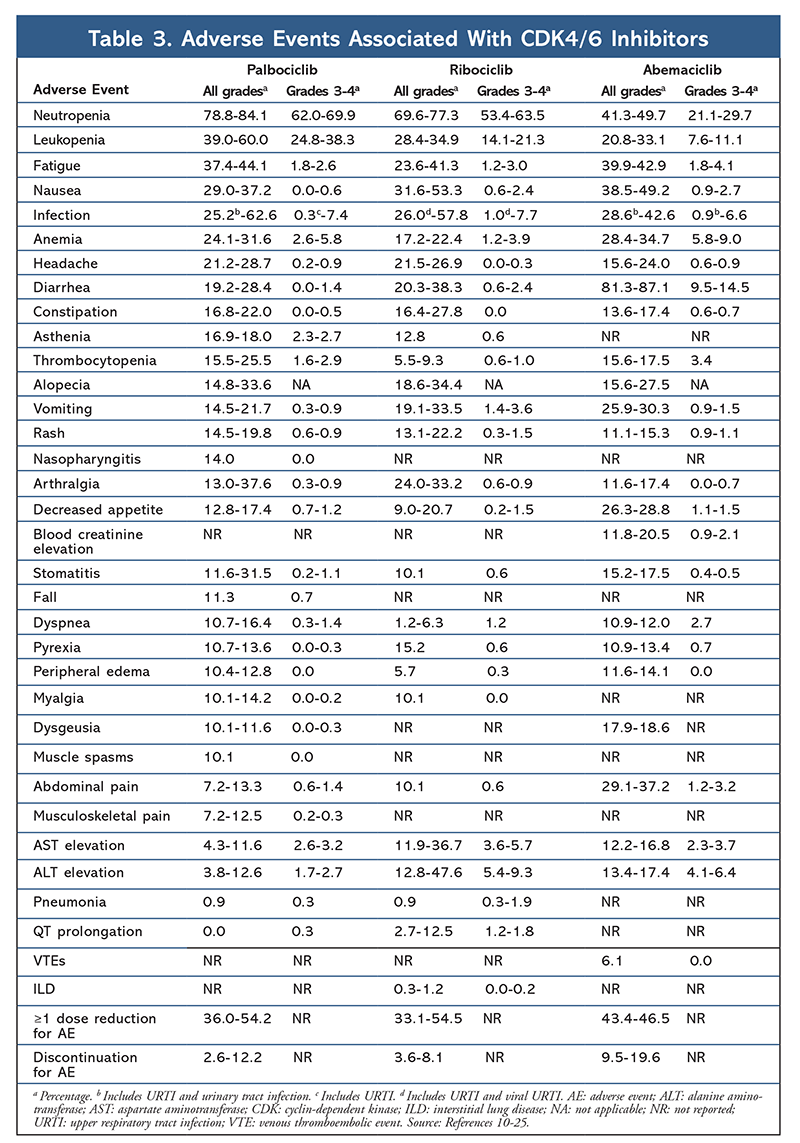
Profilul AE a rămas consecvent în toate rapoartele de studiu (TABELUL 3), neutropenia de toate gradele (78,8%-84,1%), leucopenia (39%-60%) și oboseala (37,4%-44,1%) fiind cele mai frecvent raportate AE. Ratele de neutropenie au fost ridicate; cu toate acestea, neutropenia febrilă a fost rară (până la 2%). Tolerabilitatea generală a palbociclibului a fost considerată ca fiind gestionabilă, iar agentul a determinat date pozitive privind calitatea vieții atunci când a fost utilizat în terapia combinată, comparativ cu monoterapia endocrină.9,14
Ribociclib
Un al doilea inhibitor CDK4/6, ribociclib, a fost aprobat de FDA în 2017, cu o populație de pacienți indicată mai largă. Ribociclib este aprobat pentru femeile aflate în postmenopauză și femeile aflate în pre sau perimenopauză cu cancer de sân HR+, HER2- avansat sau metastatic (ca terapie combinată cu un IA ca ET inițial sau, la femeile aflate în postmenopauză, combinat cu fulvestrant ca ET inițial sau ca urmare a progresiei bolii sub ET).7
Ribociclib a primit prima dată aprobarea FDA după ce studiul MONALEESA-2 a constatat că SFP a fost îmbunătățită atunci când medicamentul a fost administrat în asociere cu letrozol față de letrozol singur. Ratele de SLP evaluate la nivel local față de letrozol singur după 18 luni au fost de 63,0% (95% CI, 54,6-70,3) și, respectiv, 42,2% (95% CI, 34,8-49,5).15 Un raport de urmărire prelungită la 26,4 luni a demonstrat și mai mult eficacitatea și tolerabilitatea combinației.16 În ciuda îmbunătățirii SFP, datele privind SG pentru MONALEESA-2 rămân imature.
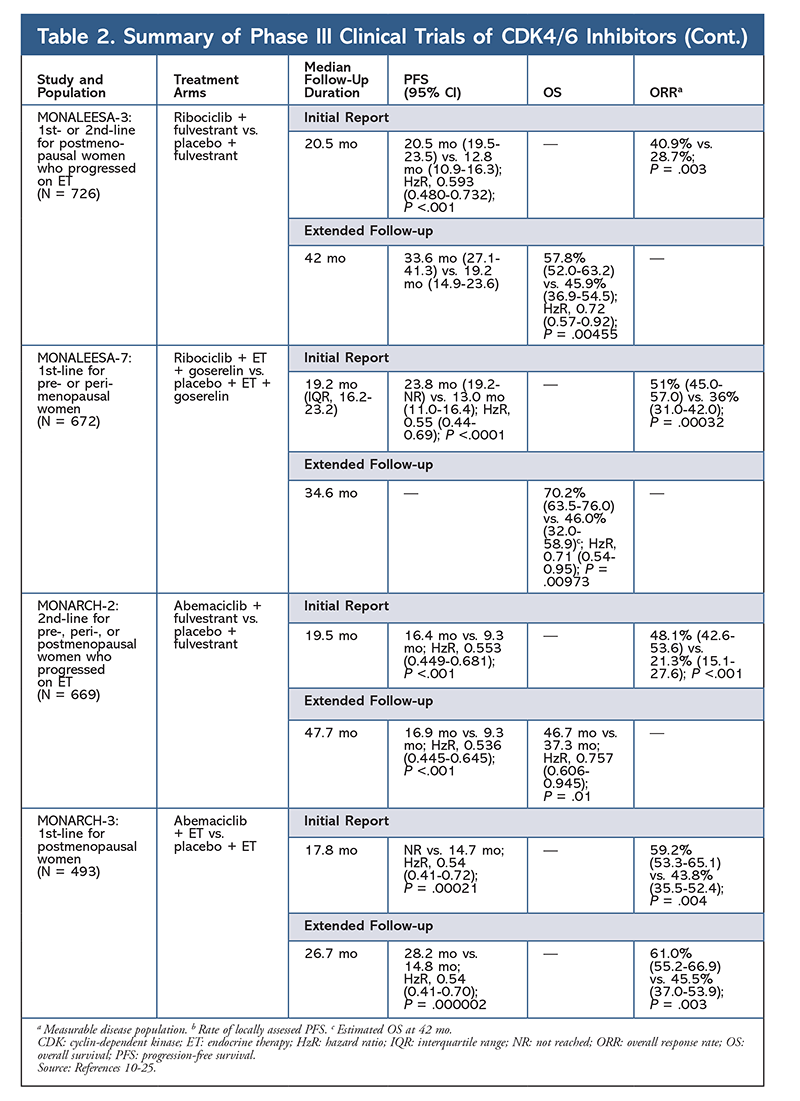
Ribociclib este, de asemenea, în curs de investigare (în MONALEESA-3) în asociere cu fulvestrant la pacientele care nu au primit tratament și la cele care au recidivat după ET. Raportul inițial a evidențiat o îmbunătățire a SFP pentru această combinație în comparație cu fulvestrantul singur (20,5 luni vs. 12,8 luni, respectiv; HzR, 0,593; 95% CI, 0,480-0,732; P <.001), ceea ce a dus la aprobarea de către FDA a acestei combinații.17 Un al doilea raport, și cel mai recent, privind inhibitorul CDK4/6, care a avut 21,6 luni suplimentare de urmărire, a demonstrat în continuare îmbunătățirea consistentă a SFP. Acest raport a dovedit, de asemenea, beneficiul pentru SG al asocierii ribociclib plus fulvestrant în comparație cu fulvestrantul singur, cu o SG estimată la 42 de luni de 57,8 % față de 45,9 %, respectiv, și o reducere cu 28 % a riscului relativ de deces (HzR, 0,72; 95% CI, 0,57-0.92; P = 0,00455).18
Un al treilea studiu clinic, MONALEESA-7, este în prezent singurul studiu de fază III care evaluează eficacitatea și siguranța unui inhibitor CDK4/6 ca terapie de primă linie pentru femeile aflate în pre sau perimenopauză care au cancer de sân metastatic. În acest studiu, ribociclib plus tamoxifen sau un AI nesteroidian (AINS) – cum ar fi letrozol sau anastrozol – plus goserelin a îmbunătățit semnificativ SFP cu 23,8 luni față de 13 luni pentru grupul placebo (HzR, 0,55; 95% CI, 0,44-0,69; P <.0001), iar combinația a condus la extinderea indicației care include femeile aflate în pre și perimenopauză.19 Un raport de urmărire prelungită a demonstrat beneficiul pentru SG al combinației ribociclib plus tamoxifen sau un AINS plus goserelin în comparație cu placebo, cu o SG estimată la 42 de luni de 70,2% față de 46,0%.20
Profilul de toxicitate pentru ribociclib este foarte asemănător cu cel al palbociclibului, neutropenia și leucopenia fiind cele mai importante reacții adverse de toate gradele și severe (gradele 3/4) raportate, deși la rate mai mici decât în cazul palbociclibului (TABELUL 3).15-20 Neutropenia febrilă a fost rară și nu au apărut noi probleme de siguranță odată cu expunerea mai îndelungată la ribociclib în niciunul dintre rapoartele de urmărire prelungită.
Abemaciclib
Cel de-al treilea inhibitor CDK4/6 care a fost aprobat de FDA este abemaciclib. Acest agent este indicat în asociere cu un IA ca ET inițial la femeile aflate în postmenopauză cu cancer mamar avansat sau în asociere cu fulvestrant la femeile aflate în pre, peri sau postmenopauză cu progresie a bolii după ET. Abemaciclib este, de asemenea, aprobat ca monoterapie la bărbații și femeile cu progresie a bolii după ET și chimioterapie anterioară în contextul metastatic.6 Agentul a obținut inițial aprobarea pe baza rezultatelor din MONARCH-1 care au demonstrat o activitate clinică promițătoare după 12 luni, cu o rată de răspuns global (ORR) de 19,7 % (95% CI, 13,3-27,5) și o durată mediană de supraviețuire a vieții (PFS) de 6 luni.5,21 În acest timp, abemaciclib a fost, de asemenea, investigat în MONARCH-2 pentru femeile aflate în pre-, peri- și postmenopauză care au progresat după ET. Acest studiu a demonstrat un beneficiu semnificativ din punct de vedere statistic în ceea ce privește SFP cu o combinație de abemaciclib plus fulvestrant față de fulvestrant singur (16,4 luni față de 9,3 luni; HzR, 0,553; 95% CI, 0,449-0,681; P <.001).22 Un studiu de urmărire extinsă cu o durată mediană de 47.7 luni a raportat rezultate ușor îmbunătățite la nivelul SFP și un beneficiu pentru SG cu combinația abemaciclib față de placebo versus fulvestrant (46,7 luni vs. 37,3 luni; IC 95%, 0,606-0,945; P = 0,01).23
La scurt timp după inițierea celor două studii cu abemaciclib, a fost demarat MONARCH-3. Acest studiu a constatat o îmbunătățire semnificativă din punct de vedere statistic a PFS și ORR cu abemaciclib plus un AINS în comparație cu brațul placebo plus AINS ca tratament de primă linie pentru femeile aflate în postmenopauză. Un raport actualizat cu 8,9 luni de urmărire suplimentară a confirmat și mai mult rezultatele PFS și ORR ale analizei inițiale; cu toate acestea, datele privind SG rămân imature, iar analiza finală a SG va fi efectuată după 315 evenimente.24,25
În general, s-a observat că abemaciclib este cel mai puternic inhibitor CDK4/6, cu o activitate excelentă la nivelul sistemului nervos central datorită structurii sale, ceea ce îi permite să traverseze bariera hemato-encefalică și să rămână mai mult timp la țintă.5 Acest lucru poate fi benefic pentru pacientele cu metastaze cerebrale. Deși abemaciclib prezintă, de asemenea, procente ridicate de reacții adverse hematologice, aceste rate sunt mult mai mici decât cele pentru alți inhibitori CDK4/6. Abemaciclib este asociat cu mai multe toxicități gastrointestinale, cum ar fi diareea, decât alți inhibitori CDK4/6 (toate gradele: 81,3%-87,1%; gradele 3-4: 9,5%-14,5%). 22-25
Rolul farmacistului
În general, profilurile de EA ale diferiților inhibitori CDK 4/6 sunt similare, dar fiecare medicament are EA unice. Cele mai frecvente EA raportate cu inhibitorii CDK4/6 sunt neutropenia, leucopenia, oboseala, greața, infecția, artralgia, anemia, cefaleea și diareea (TABELUL 3). În afară de neutropenie și leucopenie, majoritatea pacienților au raportat EA de gradul 1 sau 2. Neutropenia și leucopenia de gradul 3 sau 4, care au fost foarte frecvente cu toți inhibitorii CDK, în special cu palbociclib și ribociclib, au fost gestionate în cea mai mare parte prin întreruperea și/sau reducerea dozei. Hemograma pacientului trebuie monitorizată la momentul inițial, la fiecare 2 săptămâni pentru primele două cicluri, la începutul fiecăruia dintre cele patru cicluri ulterioare și după cum este necesar din punct de vedere clinic pentru suprimarea măduvei osoase. 6-8 Căderile, spasmele musculare și nazofaringita sunt asociate cu palbociclib, dar sunt ușoare în majoritatea cazurilor. 10,11,14 O incidență scăzută a prelungirii QT a fost raportată cu ribociclib.15-20 Abemaciclib a fost asociat cu o incidență semnificativ mai mare de diaree comparativ cu palbociclib și ribociclib; cazurile au apărut mai ales în timpul primului ciclu și au putut fi gestionate cu tratament antidiareic.22-25 Abemaciclib a fost asociat cu creșterea creatininei serice și evenimente tromboembolice venoase (în cea mai mare parte ușoare), care nu au fost raportate pentru palbociclib și ribociclib, precum și cu o incidență mai mare a durerilor abdominale.22-25 În special, în septembrie 2019, FDA a avertizat că la pacienții tratați cu inhibitori CDK4/6 pot apărea boli pulmonare interstițiale (ILD) și pneumonite rare, dar severe, care pun viața în pericol sau fatale, la pacienții tratați cu inhibitori CDK4/6.26 Prin urmare, pacienții trebuie monitorizați în mod regulat pentru simptome pulmonare care indică ILD și/sau pneumonită.
Concluzie
Aprobările palbociclibului, ribociclibului și abemaciclibului din ultimii ani au extins opțiunile de tratament pentru pacienții cu cancer de sân avansat. Deși toate posedă același mecanism de acțiune, aceste medicamente au ușoare diferențe în ceea ce privește eficacitatea și siguranța. O serie de studii în curs de desfășurare, în afara celor menționate în această recenzie, continuă să exploreze acești inhibitori la diferite populații de pacienți și cu diferite combinații de tratament. Potențialul acestor agenți de a extinde utilizarea inhibitorilor CDK4/6 în alte contexte decât cancerul mamar avansat HR+, HER2- pare promițător. 27
1. Siegel RL, Miller KD, Miller KD, Jemal A. Statisticile privind cancerul, 2020. CA Cancer J Clin. 2020;70(1):7-30.
2. Preusser M, De Mattos-Arruda L, Thill M, et al. CDK4/6 inhibitors in the treatment of patients with breast cancer: summary of a multidisciplinary round-table discussion. ESMO Open. 2018;3(5):e000368.
3. Tripathy D, Bardia A, Sellers WR. Ribociclib (LEE011): mecanismul de acțiune și impactul clinic al acestui inhibitor selectiv al kinazei dependente de ciclină 4/6 în diferite tumori solide. Clin Cancer Res. 2017;23(13):3251-3262.
4. Portman N, Alexandrou S, Carson E, et al. Overcoming CDK4/6 inhibitor resistance in ER-positive breast cancer. Endocr Relat Cancer. 2019;26(1):R15-R30.
5. Sobhani N, D’Angelo A, Pittacolo M, et al. Actualizări privind strategia și combinațiile de inhibitori CDK4/6 în cancerul de sân. Cells. 2019;8(4):E321.
6. Ibrance (palbociclib) prospect. New York, NY: Pfizer Inc; septembrie 2019.
7. Kisqali (ribociclib) prospect. East Hanover, NJ: Novartis Pharmaceuticals Corp; septembrie 2019.
8. Verzenio (abemaciclib) prospectul medicamentului. Indianapolis, IN: Eli Lilly and Co; septembrie 2019.
9. Finn RS, Crown JP, Crown JP, Lang I, et al. Inhibitorul de kinază dependentă de ciclicină 4/6 palbociclib în combinație cu letrozol versus letrozol singur ca tratament de primă linie al cancerului de sân avansat cu receptori estrogeni pozitivi, HER2-negativi (PALOMA-1/TRIO-18): un studiu randomizat de fază 2. Lancet Oncol. 2015;16(1):25-35.
10. Finn RS, Martin M, Martin M, Rugo HS, et al. Palbociclib și letrozol în cancerul de sân avansat. N Engl J Med. 2016;375(20):1925-1936.
11. Rugo HS, Finn RS, Finn RS, Diéras V, et al. Palbociclib plus letrozol ca terapie de primă linie în cancerul de sân avansat cu receptorul de estrogen pozitiv/receptorul 2 negativ al factorului de creștere epidermal uman 2, cu urmărire extinsă. Breast Cancer Res Treat. 2019;174(3):719-729.
12. Turner NC, Ro J, Ro J, André F, et al. Palbociclib în cancerul de sân avansat cu receptori hormonali pozitivi. N Engl J Med. 2015;373(3):209-219.
13. Cristofanilli M, Turner NC, Bondarenko I, et al. Fulvestrant plus palbociclib versus fulvestrant plus placebo pentru tratamentul cancerului mamar metastatic metastatic cu receptori hormonali pozitivi, HER2-negativ, care a progresat în urma unui tratament endocrin anterior (PALOMA-3): analiza finală a studiului controlat randomizat multicentric, dublu-orb, faza 3. Lancet Oncol. 2016;17(4):425-439.
14. Turner NC, Slamon DJ, Ro J, et al. Supraviețuirea generală cu palbociclib și fulvestrant în cancerul mamar avansat. N Engl J Med. 2018;379(20):1926-1936.
15. Hortobagyi GN, Stemmer SM, Burris HA, et al. Ribociclib ca terapie de primă linie pentru cancerul de sân HR-pozitiv, avansat. N Engl J Med. 2016;375(18):1738-1748.
16. Hortobagyi GN, Stemmer SM, Burris HA, et al. Rezultate actualizate din MONALEESA-2, un studiu de fază III al ribociclib plus letrozol în prima linie versus placebo plus letrozol în cancerul de sân avansat cu receptori hormonali pozitivi, HER2-negativ. Ann Oncol. 2018;29(7):1541-1547.
17. Slamon DJ, Neven P, Chia S, et al. Studiu randomizat de fază III al ribociclibului și fulvestrantului în cancerul de sân avansat cu receptori hormonali pozitivi, receptorul 2 negativ al factorului de creștere al factorului de creștere epidermal uman: MONALEESA-3. J Clin Oncol. 2018;36(24):2465-2472.
18. Slamon DJ, Neven P, Chia S, et al. Supraviețuirea generală cu ribociclib plus fulvestrant în cancerul de sân avansat. N Engl J Med. 2020;382(6):514-524.
19. Tripathy D, Im SA, Colleoni M, et al. Ribociclib plus terapie endocrină pentru femeile aflate în premenopauză cu cancer de sân avansat, cu receptori hormonali pozitivi (MONALEESA-7): un studiu randomizat, de fază 3. Lancet Oncol. 2018;19(7):904-915.
20. Im SA, Lu YS, Lu YS, Bardia A, et al. Supraviețuirea generală cu ribociclib plus terapie endocrină în cancerul de sân. N Engl J Med. 2019;381(4):307-316.
21. Dickler MN, Tolaney SM, Rugo HS, et al. MONARCH 1, un studiu de fază II al abemaciclib, un inhibitor CDK4 și CDK6, ca agent unic, la pacienții cu cancer de sân metastatic refractar HR+/HER2-. Clin Cancer Res. 2017;23(17):5218-5224.
22. Sledge GW Jr, Toi M, Neven P, et al. MONARCH 2: abemaciclib în asociere cu fulvestrant la femeile cu cancer de sân avansat HR+/HER2- care au progresat în timp ce primeau tratament endocrin. J Clin Oncol. 2017;35(25):2875-2884.
23. Sledge GW Jr, Toi M, Neven P, et al. Efectul abemaciclib plus fulvestrant asupra supraviețuirii globale în cazul cancerului de sân cu receptori hormonali pozitivi, ERBB2-negativ, care a progresat în timpul terapiei endocrine-MONARCH 2: un studiu clinic randomizat. JAMA Oncol. 2020;6(1):116-124.
24. Goetz MP, Toi M, Campone M, et al. MONARCH 3: abemaciclib ca terapie inițială pentru cancerul de sân avansat. J Clin Oncol. 2017;35(32):3638-3646.
25. Johnston S, Martin M, Martin M, Di Leo A, et al. MONARCH 3 final PFS: un studiu randomizat al abemaciclib ca terapie inițială pentru cancerul de sân avansat. NPJ Breast Cancer. 2019;17(5):5.
26. FDA. FDA avertizează cu privire la o inflamație pulmonară rară, dar severă, cu Ibrance, Kisqali și Verzenio pentru cancerul de sân. www.fda.gov/drugs/drug-safety-and-availability/fda-warns-about-rare-severe-lung-inflammation-ibrance-kisqali-and-verzenio-breast-cancer. Accesat la 15 ianuarie 2020.
27. Shah M, Nunes MR, Stearns V. Inhibitorii CDK4/6: schimbă jocul în managementul cancerului de sân avansat cu receptori hormonali pozitivi? Oncologie (Williston Park). 2018;32(5):216-222.
Contenutul acestui articol este doar în scop informativ. Conținutul nu este menit să înlocuiască consilierea profesională. Încrederea în orice informație furnizată în acest articol se face exclusiv pe propriul risc.
.
