US Pharm. 2020;45(5)(Specialty&Oncology suppl):3-8.
ABSTRACT: I de seneste år er der blevet udviklet flere nye målrettede behandlingsmuligheder for at bekæmpe resistens over for traditionel endokrin behandling af avanceret brystkræft. Tre CDK4/6-hæmmere (palbociclib, ribociclib og abemaciclib) er blevet godkendt til patienter med hormonreceptor-positiv, human epidermal vækstfaktorreceptor 2-negativ avanceret brystkræft. Hvert middel har vist sin effektivitet, men der er forskelle mellem de tre lægemidler, især i deres bivirkningsprofiler.
Brystkræft er den mest almindelige type kræft hos kvinder, med mere end 276.000 nye tilfælde anslået i 2020.1 Hormonreceptor-positiv (HR+) brystkræft, som udgør mere end 70 % af disse tilfælde, er historisk set blevet behandlet med endokrin terapi (ET), såsom selektive østrogenreceptorhæmmere og aromatasehæmmere (AI). Selv om ET fortsat er rygraden i behandlingen af HR+ brystkræft, udvikles der resistens hos op til 50 % af patienterne med fremskreden brystkræft.2 For at bekæmpe resistens er målrettede terapier blevet godkendt til HR+ brystkræft.3,4
Cyclinafhængig kinase (CDK)-inhibitorer, den nyeste klasse af interesse for fremskreden brystkræft, virker ved specifikt at hæmme CDK4/6-proteiner og blokere overgangen fra G1- til S-fasen i cellecyklusen. Denne lægemiddelklasse hæmmer kinaseaktivitet, som fosforylerer retinoblastoma-proteinvejen. Ved at blokere denne vej er CDK4/6-hæmmere i stand til at blokere cellecyklusfremskridt i midten af G1-fasen og forhindre kræftcellers progression. I de seneste år er tre CDK4/6-hæmmere (palbociclib, ribociclib og abemaciclib) blevet godkendt som kombinationsbehandlinger til HR+, human epidermal vækstfaktorreceptor 2-negativ (HER2-), avanceret eller metastatisk brystkræft5-8 . I denne artikel gennemgås disse midlers forskelle (TABEL 1), kliniske fase III-forsøg (TABEL 2) og bivirkningsprofiler (AE) (TABEL 3).
Palbociclib
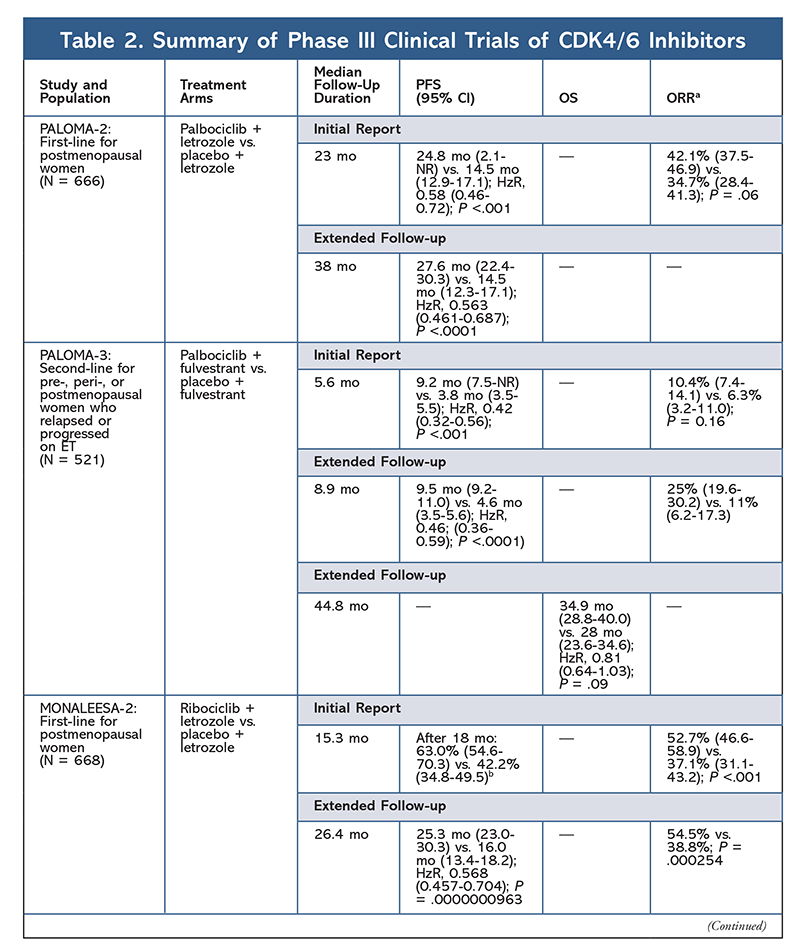
I 2015 blev palbociclib den første CDK4/6-hæmmer, der fik FDA-godkendelse til behandling af HR+, HER2- brystkræft (i kombination med en AI som initial ET hos postmenopausale kvinder eller hos mænd, eller i kombination med fulvestrant hos patienter med sygdomsprogression efter ET).6,9-14 Palbociclib blev oprindeligt godkendt efter positive resultater fra fase II-undersøgelsen PALOMA-1, som sammenlignede palbociclib plus letrozol med letrozol alene som initialbehandling af ET-naivt fremskreden brystkræftpatienter9 .
Disse resultater førte til to fase III-studier, der yderligere evaluerede palbociclib’s effekt i denne patientpopulation. De første resultater af PALOMA-2 bekræftede virkningerne af palbociclib plus letrozol og viste en forbedret progressionsfri overlevelse (PFS) i forhold til letrozol alene (henholdsvis 24,8 mdr. vs. 14,5 mdr.; hazard ratio for sygdomsprogression eller død, 0,58; 95 % CI, 0,46-0,72; P <.001). En langtidsopfølgningsundersøgelse på 38 måneder bekræftede yderligere palbociclib’s effekt på PFS med en stigning til 27,6 måneder mod 14,5 måneder for letrozol alene (HzR, 0,563; 95% CI, 0,461-0,687; P <.0001). Opfølgningsundersøgelsen rapporterede også en konsekvent PFS-forbedring med palbociclib plus letrozol på tværs af alle undersøgte undergrupper samt forsinket mediantid til iværksættelse af efterfølgende behandling. De samlede overlevelsesdata (OS) for den første og opfølgningsrapporterne var imidlertid umodne, og de indskrevne patienter følges med henblik på overlevelse.10,11
Kort efter starten af PALOMA-2 blev et andet fase III-studie, PALOMA-3, påbegyndt for at vurdere sikkerheden og effektiviteten af palbociclib plus fulvestrant hos præmenopausale eller postmenopausale kvinder med HR+ avanceret brystkræft, der er progredieret på tidligere ET. Den første rapport efter 5,6 måneders opfølgning viste en forbedring af den mediane PFS (9,2 mdr. vs. 3,8 mdr.) med en 58 % reduktion i progression (HzR, 0,42; 95 % CI, 0,32-0,56; P <.001).12 En forudspecificeret analyse af OS i PALOMA-3-forsøget, med en medianopfølgning på 44.8 måneder, viste, at forskellene i OS for hele intent-to-treat-gruppen ikke nåede op på statistisk signifikans, men at kombinationen forlængede OS med 10 måneder hos patienter, der var følsomme over for tidligere ET.14
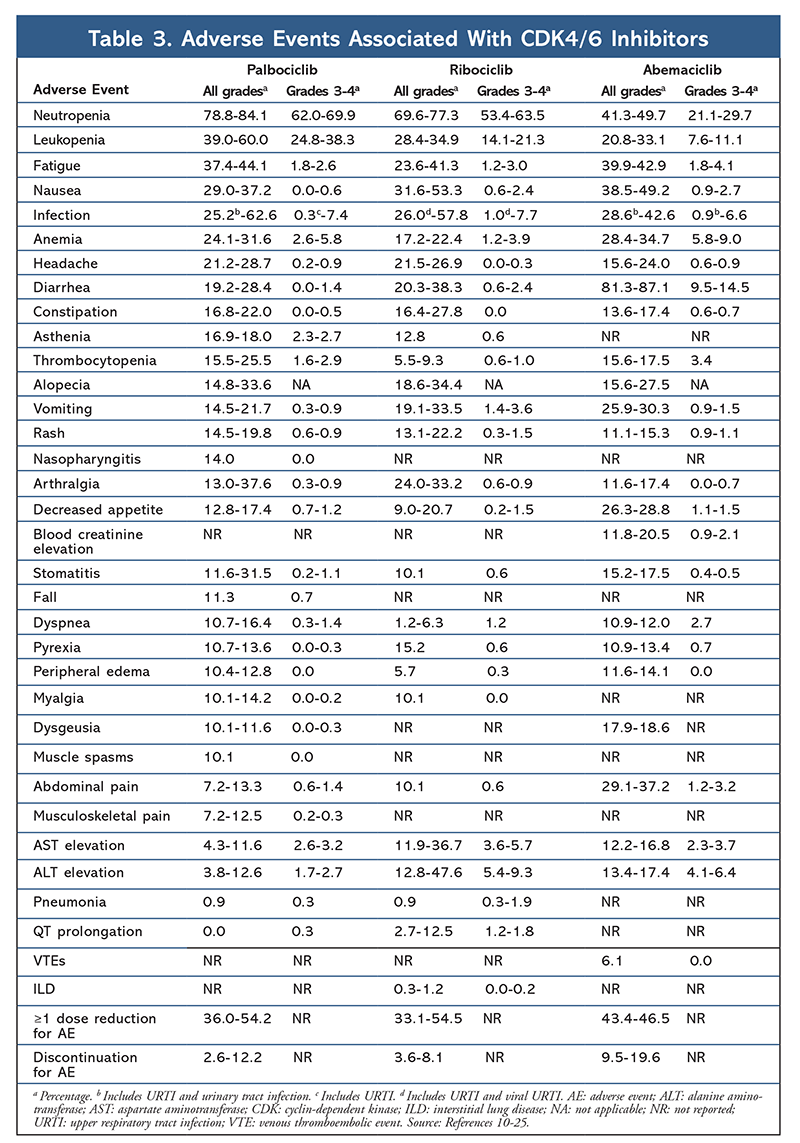
AE-profilen forblev ensartet på tværs af alle forsøgsrapporter (TABEL 3), med all-grade neutropeni (78,8 %-84,1 %), leukopeni (39 %-60 %) og træthed (37,4 %-44,1 %) som de hyppigst rapporterede AE’er. Raterne af neutropeni var høje; febril neutropeni var dog sjælden (op til 2 %). Den overordnede tolerabilitet af palbociclib blev anset for at være håndterbar, og midlet resulterede i positive data om livskvalitet, når det blev anvendt i kombinationsbehandling sammenlignet med endokrin monoterapi.9,14
Ribociclib
En anden CDK4/6-hæmmer, ribociclib, blev FDA-godkendt i 2017 med en bredere indiceret patientpopulation. Ribociclib er godkendt til postmenopausale og præ- eller perimenopausale kvinder med HR+, HER2- avanceret eller metastatisk brystkræft (som kombinationsbehandling med en AI som initial ET eller, hos postmenopausale kvinder, kombineret med fulvestrant som initial ET eller efter sygdomsprogression på ET).7
Ribociclib fik først FDA-godkendelse, efter at MONALEESA-2-studiet viste, at PFS blev forbedret, når lægemidlet blev givet i kombination med letrozol sammenlignet med letrozol alene. Raterne af lokalt vurderet PFS i forhold til letrozol alene efter 18 måneder var henholdsvis 63,0 % (95 % CI, 54,6-70,3) og 42,2 % (95 % CI, 34,8-49,5).15 En udvidet opfølgningsrapport efter 26,4 måneder viste yderligere kombinationen effektivitet og tolerabilitet.16 På trods af forbedringen i PFS er OS-data for MONALEESA-2 stadig umodne.
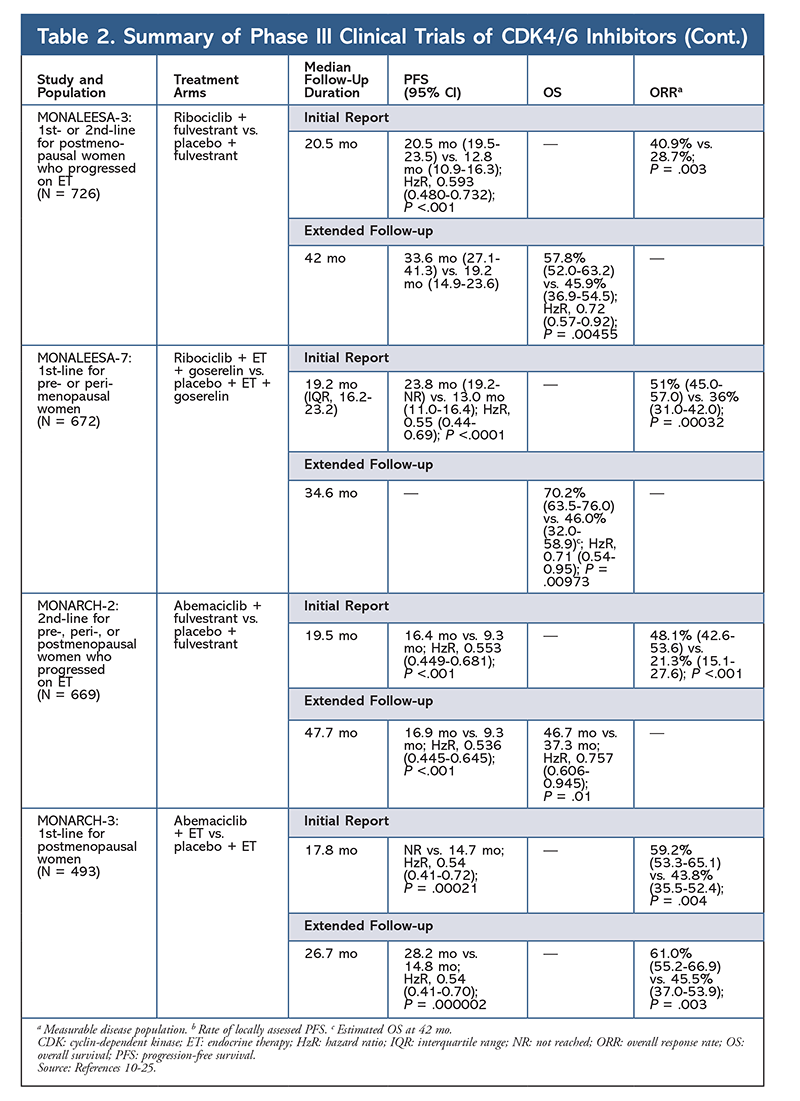
Ribociclib undersøges også (i MONALEESA-3) i kombination med fulvestrant hos behandlingsnaive patienter og hos patienter, der fik tilbagefald efter ET. Den første rapport viste en forbedret PFS for kombinationen sammenlignet med fulvestrant alene (henholdsvis 20,5 mdr. vs. 12,8 mdr.; HzR, 0,593; 95% CI, 0,480-0,732; P <.001), hvilket resulterede i FDA-godkendelse af denne kombination.17 En anden og den seneste rapport om CDK4/6-hæmmere, som havde yderligere 21,6 måneders opfølgning, viste yderligere den konsekvente PFS-forbedring. Denne rapport beviste også OS-fordelen ved ribociclib plus fulvestrant sammenlignet med fulvestrant alene, med en estimeret OS efter 42 måneder på henholdsvis 57,8 % mod 45,9 % og en 28 % reduktion i den relative risiko for død (HzR, 0,72; 95 % CI, 0,57-0.92; P = .00455).18
Et tredje klinisk forsøg, MONALEESA-7, er i øjeblikket det eneste fase III-forsøg, der evaluerer effektiviteten og sikkerheden af en CDK4/6-hæmmer som førstegangsbehandling til præ- eller perimenopausale kvinder, der har metastatisk brystkræft. I dette forsøg forbedrede ribociclib plus tamoxifen eller en ikke-steroidal AI (NSAI) – såsom letrozol eller anastrozol – plus goserelin PFS signifikant med 23,8 måneder i forhold til 13 måneder for placebogruppen (HzR, 0,55; 95% CI, 0,44-0,69; P <.0001), og kombinationen førte til den udvidede indikation, der omfatter præ- og perimenopausale kvinder19. En udvidet opfølgningsrapport viste OS-fordelen ved kombinationen ribociclib plus tamoxifen eller et NSAI plus goserelin sammenlignet med placebo, med en estimeret 42-måneders OS på 70,2 % versus 46,0 %.20
Toksicitetsprofilen for ribociclib ligner i høj grad den for palbociclib, med neutropeni og leukopeni som de højeste all-grade og alvorlige (grader 3/4) AE’er, der er rapporteret, om end i lavere grad end for palbociclib (TABEL 3).15-20 febril neutropeni var sjælden, og der opstod ingen nye sikkerhedsproblemer ved længere eksponering for ribociclib i nogen af de udvidede opfølgningsrapporter.
Abemaciclib
Den tredje CDK4/6-hæmmer, der er blevet godkendt af FDA, er abemaciclib. Dette middel er indiceret i kombination med en AI som initial ET hos postmenopausale kvinder med fremskreden brystkræft eller i kombination med fulvestrant hos præ-, peri- eller postmenopausale kvinder med sygdomsprogression efter ET. Abemaciclib er også godkendt som monoterapi til mænd og kvinder med sygdomsprogression efter ET og forudgående kemoterapi i metastaserende omgivelser.6 Midlet blev oprindeligt godkendt på baggrund af resultaterne fra MONARCH-1, der viste lovende klinisk aktivitet efter 12 måneder med en samlet responsrate (ORR) på 19,7 % (95 % CI, 13,3-27,5) og en median PFS på 6 måneder.5,21 I denne periode blev abemaciclib også undersøgt i MONARCH-2 til præ-, peri- og postmenopausale kvinder, der var gået fremad efter ET. Denne undersøgelse viste en statistisk signifikant PFS-fordel ved en kombination af abemaciclib plus fulvestrant i forhold til fulvestrant alene (16,4 mdr. vs. 9,3 mdr.; HzR, 0,553; 95 % CI, 0,449-0,681; P <.001).22 En udvidet opfølgningsundersøgelse med en medianvarighed på 47.7 måneder rapporterede lidt forbedrede PFS-resultater og OS-fordel med abemaciclib-kombinationen i forhold til placebo versus fulvestrant (46,7 mdr. vs. 37,3 mdr.; 95 % CI, 0,606-0,945; P = .01).23
Kort efter indledningen af de to abemaciclib-forsøg blev MONARCH-3 påbegyndt. Dette forsøg fandt en statistisk signifikant forbedring af PFS og ORR med abemaciclib plus et NSAI sammenlignet med placebo-plus-NSAI-armen som førstelinjebehandling til postmenopausale kvinder. En opdateret rapport med 8,9 måneders yderligere opfølgning bekræftede yderligere PFS- og ORR-resultaterne fra den oprindelige analyse; OS-dataene er dog stadig umodne, og den endelige OS-analyse vil blive gennemført efter 315 begivenheder.24,25
Overordnet set er abemaciclib blevet bemærket som den mest potente CDK4/6-hæmmer med fremragende aktivitet i centralnervesystemet på grund af sin struktur, hvilket gør det muligt for den at krydse blod-hjernebarrieren og forblive længere på målet.5 Dette kan være til gavn for patienter med hjernemetastaser. Selv om abemaciclib også har høje procenter af hæmatologiske AE’er, er disse procenter meget lavere end for andre CDK4/6-hæmmere. Abemaciclib er forbundet med flere gastrointestinale toksiciteter, såsom diarré, end andre CDK4/6-hæmmere (alle grader: 81,3 %-87,1 %; grader 3-4: 9,5 %-14,5 %).22-25
Apotekerens rolle
Overordnet set er AE-profilerne for de forskellige CDK 4/6-hæmmere ens, men hvert lægemiddel har unikke AE’er. De mest almindelige AE’er, der er rapporteret med CDK4/6-hæmmere, er neutropeni, leukopeni, træthed, kvalme, infektion, arthralgi, anæmi, hovedpine og diarré (TABEL 3). Bortset fra neutropeni og leukopeni rapporterede størstedelen af patienterne grad 1 eller 2 AE’er. Neutropeni og leukopeni af grad 3 eller 4, som var meget almindelige med alle CDK-hæmmere, især palbociclib og ribociclib, blev for det meste håndteret med dosisafbrydelse og/eller -reduktion. Patientens CBC bør overvåges ved baseline, hver 2. uge i de første to cyklusser, i begyndelsen af hver af de efterfølgende fire cyklusser og efter klinisk behov for knoglemarvsundertrykkelse.6-8 Fald, muskelspasmer og nasopharyngitis er forbundet med palbociclib, men er milde i de fleste tilfælde.10,11,14 Der er rapporteret en lav forekomst af QT-forlængelse med ribociclib.15-20 Abemaciclib var forbundet med en signifikant højere forekomst af diarré sammenlignet med palbociclib og ribociclib; tilfældene opstod oftest i løbet af den første cyklus og kunne håndteres med antidiarrébehandling.22-25 Abemaciclib var forbundet med serumkreatininforhøjelse og venøse tromboemboliske hændelser (for det meste lette), som ikke blev rapporteret for palbociclib og ribociclib, og en højere forekomst af mavesmerter.22-25 Især advarede FDA i september 2019 om, at der kan forekomme sjælden, men alvorlig, livstruende eller dødelig interstitiel lungesygdom (ILD) og pneumonitis hos patienter, der behandles med CDK4/6-hæmmere.26 Derfor bør patienterne overvåges regelmæssigt for lungesymptomer, der indikerer ILD og/eller pneumonitis.
Konklusion
Godkendelserne af palbociclib, ribociclib og abemaciclib i de seneste år har udvidet behandlingsmulighederne for patienter med fremskreden brystkræft. Selv om de alle har den samme virkningsmekanisme, har disse lægemidler små forskelle i effektivitet og sikkerhed. En række igangværende undersøgelser ud over dem, der er nævnt i denne gennemgang, fortsætter med at undersøge disse inhibitorer i forskellige patientpopulationer og med forskellige behandlingskombinationer. Disse midlers potentiale til at udvide brugen af CDK4/6-hæmmere til andre indstillinger end HR+, HER2-avanceret brystkræft synes lovende.27
1. Siegel RL, Miller KD, Jemal A. Cancerstatistik, 2020. CA Cancer J Clin. 2020;70(1):7-30.
2. Preusser M, De Mattos-Arruda L, Thill M, et al. CDK4/6-inhibitorer i behandlingen af patienter med brystkræft: resumé af en tværfaglig rundbordsdiskussion. ESMO Open. 2018;3(5):e000368.
3. Tripathy D, Bardia A, Sellers WR. Ribociclib (LEE011): virkningsmekanisme og klinisk virkning af denne selektive cyclinafhængige kinase 4/6-hæmmer i forskellige solide tumorer. Clin Cancer Res. 2017;23(13):3251-3262.
4. Portman N, Alexandrou S, Carson E, et al. Overvindelse af CDK4/6-inhibitorresistens i ER-positiv brystkræft. Endocr Relat Cancer. 2019;26(1):R15-R30.
5. Sobhani N, D’Angelo A, Pittacolo M, et al. Opdateringer om CDK4/6-hæmningsstrategi og kombinationer i brystkræft. Cells. 2019;8(4):E321.
6. Ibrance (palbociclib) indlægsseddel. New York, NY: Pfizer Inc; september 2019.
7. Kisqali (ribociclib) indlægsseddel. East Hanover, NJ: Novartis Pharmaceuticals Corp; september 2019.
8. Verzenio (abemaciclib) indlægsseddel. Indianapolis, IN: Eli Lilly and Co; september 2019.
9. Finn RS, Crown JP, Lang I, et al. Den cyclinafhængige kinase 4/6-hæmmer palbociclib i kombination med letrozol versus letrozol alene som førstegangsbehandling af østrogenreceptor-positiv, HER2-negativ, fremskreden brystkræft (PALOMA-1/TRIO-18): en randomiseret fase 2-undersøgelse. Lancet Oncol. 2015;16(1):25-35.
10. Finn RS, Martin M, Rugo HS, et al. Palbociclib og letrozol i fremskreden brystkræft. N Engl J Med. 2016;375(20):1925-1936.
11. Rugo HS, Finn RS, Diéras V, et al. Palbociclib plus letrozol som førstelinjebehandling af østrogenreceptor-positiv/human epidermal vækstfaktorreceptor 2-negativ avanceret brystkræft med udvidet opfølgning. Breast Cancer Res Treat. 2019;174(3):719-729.
12. Turner NC, Ro J, André F, et al. Palbociclib i hormonreceptor-positiv avanceret brystkræft. N Engl J Med. 2015;373(3):209-219.
13. Cristofanilli M, Turner NC, Bondarenko I, et al. Fulvestrant plus palbociclib versus fulvestrant plus placebo til behandling af hormonreceptor-positiv, HER2-negativ metastatisk brystkræft, der er progredieret efter tidligere endokrin behandling (PALOMA-3): endelig analyse af det multicenter, dobbeltblindede, randomiserede, kontrollerede fase 3-studie. Lancet Oncol. 2016;17(4):425-439.
14. Turner NC, Slamon DJ, Slamon DJ, Ro J, et al. Samlet overlevelse med palbociclib og fulvestrant ved fremskreden brystkræft. N Engl J Med. 2018;379(20):1926-1936.
15. Hortobagyi GN, Stemmer SM, Burris HA, et al. Ribociclib som førstelinjebehandling til HR-positiv, fremskreden brystkræft. N Engl J Med. 2016;375(18):1738-1748.
16. Hortobagyi GN, Stemmer SM, Burris HA, et al. Opdaterede resultater fra MONALEESA-2, et fase III-studie af første linje af ribociclib plus letrozol versus placebo plus letrozol i hormonreceptor-positiv, HER2-negativ avanceret brystkræft. Ann Oncol. 2018;29(7):1541-1547.
17. Slamon DJ, Neven P, Chia S, et al. Fase III randomiseret undersøgelse af ribociclib og fulvestrant i hormonreceptor-positiv, human epidermal vækstfaktorreceptor 2-negativ avanceret brystkræft: MONALEESA-3. J Clin Oncol. 2018;36(24):2465-2472.
18. Slamon DJ, Neven P, Chia S, et al. Samlet overlevelse med ribociclib plus fulvestrant i avanceret brystkræft. N Engl J Med. 2020;382(6):514-524.
19. Tripathy D, Im SA, Colleoni M, et al. Ribociclib plus endokrin terapi til præmenopausale kvinder med hormonreceptor-positiv, fremskreden brystkræft (MONALEESA-7): et randomiseret fase 3-studie. Lancet Oncol. 2018;19(7):904-915.
20. Im SA, Lu YS, Bardia A, et al. Samlet overlevelse med ribociclib plus endokrin behandling af brystkræft. N Engl J Med. 2019;381(4):307-316.
21. Dickler MN, Tolaney SM, Rugo HS, et al. MONARCH 1, en fase II-undersøgelse af abemaciclib, en CDK4- og CDK6-hæmmer, som et enkelt middel, hos patienter med refraktær HR+/HER2- metastatisk brystkræft. Clin Cancer Res. 2017;23(17):5218-5224.
22. Sledge GW Jr Jr, Toi M, Neven P, et al. MONARCH 2: abemaciclib i kombination med fulvestrant hos kvinder med HR+/HER2- avanceret brystkræft, som havde udviklet sig, mens de modtog endokrin behandling. J Clin Oncol. 2017;35(25):2875-2884.
23. Sledge GW Jr Jr, Toi M, Neven P, et al. Effekten af abemaciclib plus fulvestrant på den samlede overlevelse ved hormonreceptor-positiv, ERBB2-negativ brystkræft, der progredierede under endokrin behandling-MONARCH 2: et randomiseret klinisk forsøg. JAMA Oncol. 2020;6(1):116-124.
24. Goetz MP, Toi M, Campone M, et al. MONARCH 3: abemaciclib som indledende behandling af fremskreden brystkræft. J Clin Oncol. 2017;35(32):3638-3646.
25. Johnston S, Martin M, Di Leo A, et al. MONARCH 3 final PFS: a randomized study of abemaciclib as initial therapy for advanced breast cancer. NPJ Breast Cancer. 2019;17(5):5.
26. FDA. FDA advarer om sjælden, men alvorlig lungebetændelse med Ibrance, Kisqali og Verzenio til brystkræft. www.fda.gov/drugs/drug-safety-and-availability/fda-warns-about-rare-severe-lung-inflammation-ibrance-kisqali-and-verzenio-breast-cancer. Tilgået 15. januar 2020.
27. Shah M, Nunes MR, Stearns V. CDK4/6-hæmmere: game changers in the management of hormone receptor-positive advanced breast cancer? Onkologi (Williston Park). 2018;32(5):216-222.
Indholdet i denne artikel er kun til oplysningsformål. Indholdet er ikke ment som en erstatning for professionel rådgivning. Tillid til alle oplysninger i denne artikel er udelukkende på egen risiko.
