Enthalpy
La termodinamica è lo studio della relazione tra calore (o energia) e lavoro. L’entalpia è un fattore centrale della termodinamica. È il contenuto di calore di un sistema. Il calore che entra o esce dal sistema durante una reazione è il cambiamento di entalpia. Se l’entalpia del sistema aumenta (cioè quando l’energia viene aggiunta) o diminuisce (perché l’energia viene ceduta) è un fattore cruciale che determina se una reazione può avvenire.
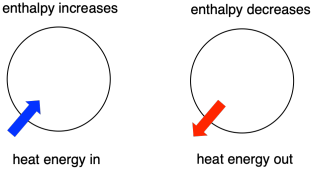
A volte, chiamiamo l’energia delle molecole sottoposte a cambiamento “entalpia interna”. A volte, la chiamiamo “entalpia del sistema”. Queste due frasi si riferiscono alla stessa cosa. Allo stesso modo, l’energia delle molecole che non partecipano alla reazione si chiama “entalpia esterna” o “entalpia dell’ambiente”.
In parole povere, i cambiamenti di energia che abbiamo visto nell’introduzione alla termodinamica erano cambiamenti di entalpia. Vedremo nella prossima sezione che c’è un altro fattore energetico, l’entropia, che dobbiamo anche considerare nelle reazioni. Per ora, guarderemo solo l’entalpia.
- L’entalpia è il contenuto di calore di un sistema.
- La variazione di entalpia di una reazione è approssimativamente equivalente alla quantità di energia persa o guadagnata durante la reazione.
- Una reazione è favorita se l’entalpia del sistema diminuisce durante la reazione.
Questa ultima affermazione è molto simile alla descrizione dell’energetica nella pagina precedente. Se un sistema subisce una reazione e cede energia, il suo stesso contenuto energetico diminuisce. Gli rimane meno energia se ne ha ceduta un po’. Perché l’energia di un insieme di molecole cambia quando avviene una reazione? Per rispondere, dobbiamo pensare a cosa succede in una reazione chimica.
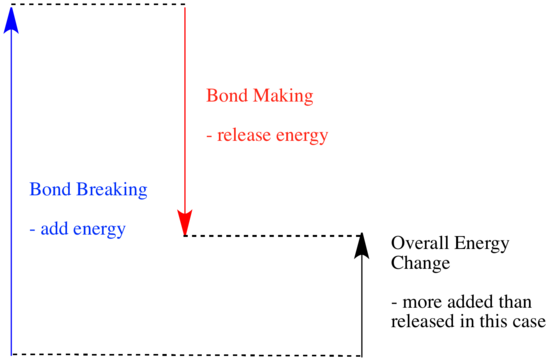
In una reazione, c’è un cambiamento nel legame chimico. Alcuni dei legami nei reagenti sono rotti, e nuovi legami sono fatti per formare i prodotti. Rompere i legami costa energia, ma l’energia viene rilasciata quando si creano nuovi legami.
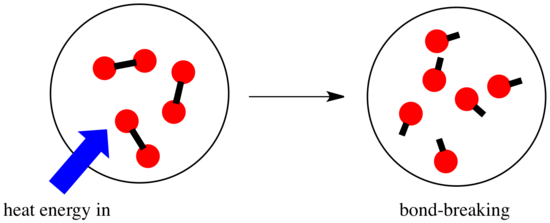
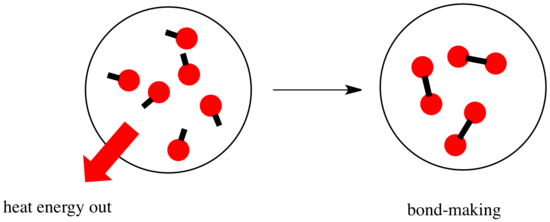
Se una reazione è in grado di andare avanti può dipendere dall’equilibrio tra queste fasi di creazione e rottura dei legami.
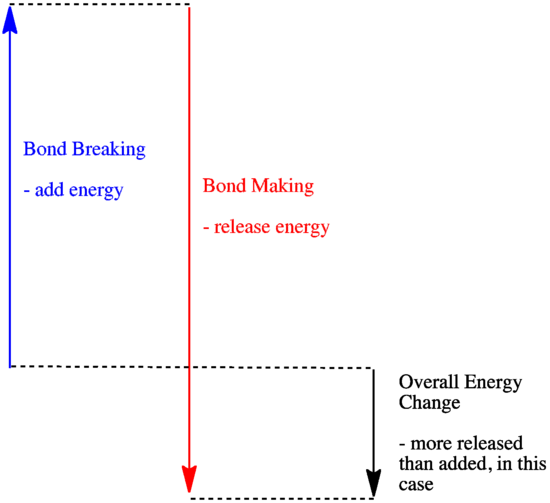
- Una reazione è esotermica se viene rilasciata più energia dalla formazione di nuovi legami di quanta ne venga consumata dalla rottura dei vecchi.
- Una reazione è esotermica se i legami più deboli sono scambiati con quelli più forti.
- Una reazione è endotermica se la rottura dei legami costa più energia di quella fornita nella formazione dei legami.
Le energie di legame (la quantità di energia che deve essere aggiunta per rompere un legame) sono un fattore importante nel determinare se una reazione avverrà. Le energie di legame non sono sempre facili da prevedere, perché la forza di un legame dipende da una serie di fattori. Tuttavia, molte persone hanno fatto un sacco di lavoro per misurare la forza dei legami, e hanno raccolto le informazioni in tabelle, così se hai bisogno di sapere quanto è forte un legame, puoi semplicemente cercare le informazioni di cui hai bisogno.
| Bond | Energia di legame (kcal/mol) | Bond | Energia di legame (kcal/mol) |
| H-H | 104 | O-H | 111 |
| C-C | 83 | C-H | 99 |
| O=O | 119 | N-H | 93 |
| N=N | 226 | C=O | 180 |
Per esempio, supponiamo che tu voglia sapere se la combustione del metano è una reazione esotermica o endotermica. Immagino che sia esotermica, perché questa reazione (e altre simili) è usata per fornire calore a molte case bruciando gas naturale nei forni.
La “combustione” del metano significa che viene bruciato in aria, in modo che reagisca con l’ossigeno. I prodotti della combustione degli idrocarburi sono principalmente anidride carbonica e acqua. L’atomo di carbonio del metano (CH4) viene incorporato in una molecola di anidride carbonica. Gli atomi di idrogeno vengono incorporati nelle molecole di acqua. Ci sono quattro atomi di idrogeno nel metano, quindi sono sufficienti per fare due molecole di H2O.
- Quattro legami C-H devono essere rotti nella combustione del metano.
- Quattro nuovi legami O-H sono fatti quando gli idrogeni del metano sono aggiunti in nuove molecole di acqua.
- Due nuovi legami C=O sono creati quando il carbonio del metano è aggiunto in una molecola di CO2.
L’altro pezzo del puzzle è la fonte di ossigeno per la reazione. L’ossigeno è presente nell’atmosfera principalmente come O2. Poiché abbiamo bisogno di due atomi di ossigeno nella molecola di CO2 e altri due atomi di ossigeno per le due molecole d’acqua, abbiamo bisogno di un totale di quattro atomi di ossigeno per la reazione, che potrebbero essere forniti da due molecole di O2.
-
Due legami O=O devono essere rotti per fornire gli atomi di ossigeno per i prodotti.
In tutto, sono quattro legami C-H e due O=O rotti, più due legami C=O e quattro O-H fatti. Sono 4 x 99 kcal/mol per i legami C-H e 2 x 119 kcal/mol per i legami O=O, per un totale di 634 kJ/mol aggiunte. La reazione libera 2 x 180 kcal/mol per i legami C=O e 4 x 111 kcla/mol per i legami OH, per un totale di 804 kcal/mol. Nel complesso, ci sono 170 kcal/mol in più rilasciate rispetto a quelle consumate.
Questo significa che la reazione è esotermica, quindi produce calore. Probabilmente è un buon modo per riscaldare la tua casa.
