- Che cos’è l’entropia?
- Cos’è la terza legge della termodinamica?
- Importanza della terza legge della termodinamica
La terza legge della termodinamica afferma che quando la temperatura di un sistema si avvicina allo zero assoluto, la sua entropia diventa costante, o il cambiamento di entropia è zero. La terza legge della termodinamica predice le proprietà di un sistema e il comportamento dell’entropia in un ambiente unico noto come temperatura assoluta.
L’entropia di un sistema limitato o isolato diventa costante quando la sua temperatura si avvicina alla temperatura assoluta (zero assoluto).
La termodinamica è una delle branche più importanti e ampiamente studiate della scienza fisica. Oltre a tormentare gli studenti di ingegneria meccanica per la maggior parte della loro vita accademica, la sua ubiquità si vede dalla brezza fredda del mio condizionatore d’aria a uno dei pinnacoli dell’era industriale – il motore a vapore. La sua applicazione è regolata da tre leggi, conosciute come le Leggi della Termodinamica. Le leggi definiscono come il lavoro, il calore e l’energia influenzano un sistema. Un sistema è una qualsiasi regione dell’Universo che è finitamente delimitata attraverso la quale l’energia viene trasferita. Tutto ciò che si trova al di fuori di questo confine è l’ambiente circostante.
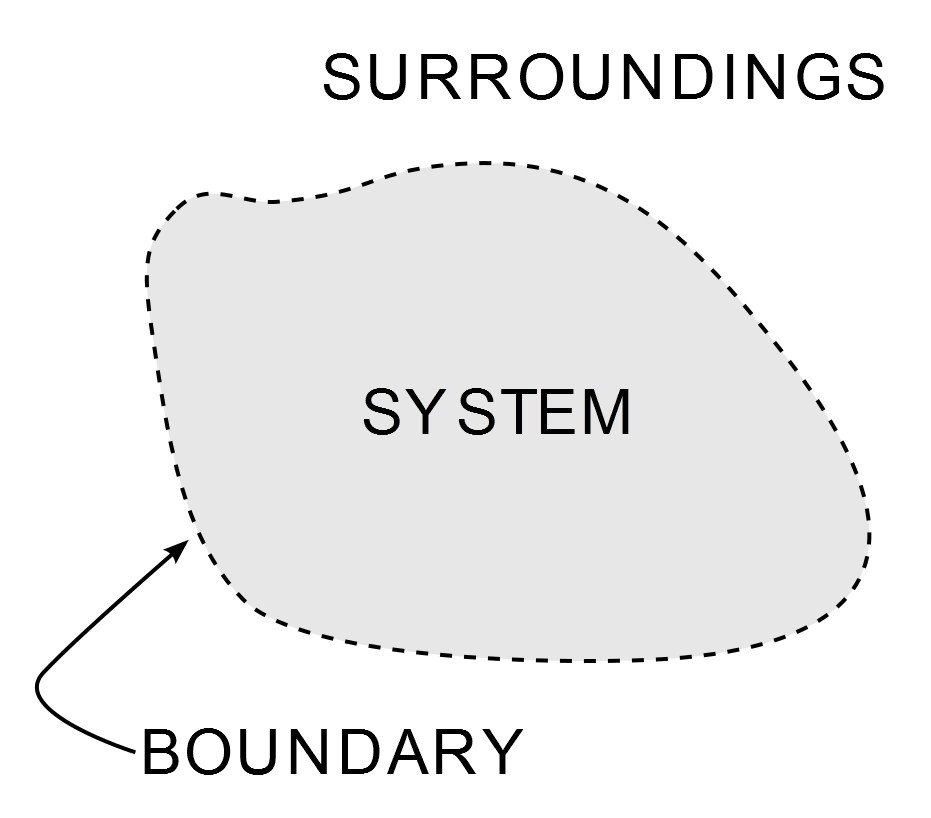
Illustrazione di un sistema in termodinamica. (Photo Credit : Wavesmikey / Wikipedia Commons)
Che cos’è l’entropia?
Mentre la prima legge della termodinamica implica che l’Universo è iniziato con un’energia utilizzabile finita, dove un sistema che attinge energia la spenderà in parte per fare lavoro e in parte per aumentare la sua temperatura interna, la seconda legge ne esplora le implicazioni. Ciò include la conversione di questa energia utilizzabile finita in energia inutilizzabile; per esempio, la formazione della materia che avviene miliardi di anni fa a causa della condensazione dell’energia con cui l’Universo è iniziato. In questo processo, l’energia utilizzabile finita è ora convertita in energia inutilizzabile.
Questa energia inutilizzabile è misurata da qualcosa chiamato “Entropia”, un barometro per misurare la casualità o il disordine in un sistema.
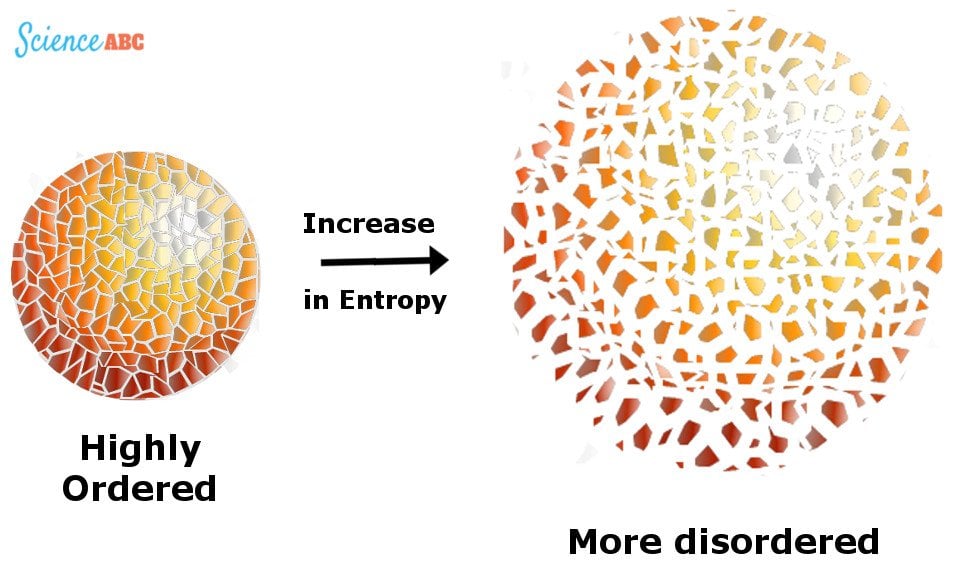
Illustrazione dell’entropia come aumento del disordine.
L’Universo è come una stanza piena di vestiti che giacciono in modo disorganizzato. L’entropia di questo sistema aumenta man mano che sempre più vestiti vengono usati e scartati, completando il disordine, a meno che l’abitante non faccia uno sforzo per raccoglierli e organizzarli, il che riduce questo disordine.
Considerando l’Universo come un unico sistema, non c’è nulla nei suoi dintorni da cui ricavare energia, quindi con tutta la sua energia convertita in energia inutilizzabile, tutto ciò che rimane è un luogo freddo e buio. Questo è chiamato la morte termica ed è uno dei modi in cui l’Universo potrebbe finire. Un sistema delimitato come il nostro Universo possiede fonti finite di energia, come le sue stelle luminose, che bruceranno per eoni prima di arrendersi alle crudeli leggi della natura.

Cos’è la terza legge della termodinamica?
La terza legge della termodinamica prevede le proprietà di un sistema e il comportamento dell’entropia in un ambiente unico noto come temperatura assoluta. La temperatura assoluta è la temperatura più bassa conosciuta e stabilisce un limite inferiore alla gamma di temperature dell’Universo.
Che figata! No, seriamente, quanto è freddo? La temperatura assoluta è 0 Kelvin, l’unità standard della temperatura o -273,15 gradi Celsius! La temperatura assoluta è anche conosciuta come zero assoluto in alcuni circoli e paesi. Questa scala ti darà un’idea.
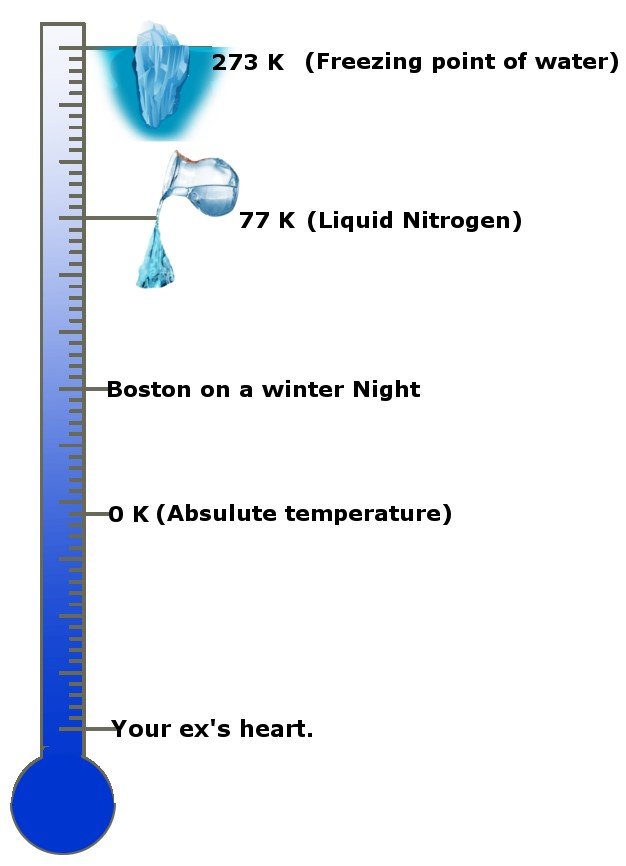
La terza legge afferma che quando la temperatura di un sistema si avvicina allo zero assoluto, la sua entropia diventa costante, o il cambiamento di entropia è zero.

L’affermazione è rappresentata da questa equazione, dove T rappresenta la temperatura e delta S è il cambiamento dell’entropia del sistema. La denotazione “tende a zero” rappresentata da una freccia che punta verso lo zero implica che quando la temperatura diminuisce ad un valore infinitesimale, il sistema raggiunge un’entropia costante attingendo energia dall’ambiente circostante, ma come detta la prima legge, parte di questa energia si aggiungerà all’energia interna del sistema, negando così uno stato di entropia costante.
Importanza della terza legge della termodinamica
La terza legge è raramente applicabile alla nostra vita quotidiana e regola la dinamica degli oggetti alle più basse temperature conosciute. Essa definisce quello che viene chiamato un “cristallo perfetto”, i cui atomi sono incollati nelle loro posizioni. Il cristallo perfetto non possiede quindi assolutamente nessuna entropia, che è raggiungibile solo alla temperatura assoluta.
Il concetto di entropia è stato anche popolare in alcune teorie che definiscono oggettivamente il flusso continuo del tempo, come l’aumento lineare dell’entropia dell’Universo.
Idealmente, a 0 Kelvin, le variazioni di entropia per le reazioni riguardanti la formazione della materia saranno nulle, anche se praticamente tutta la materia manifesta una certa quantità di entropia, a causa della presenza della più piccola quantità di calore. Il più freddo che abbiamo misurato è 3 K, nelle lontane profondità dell’Universo, oltre le stelle e le galassie.
In altre parole, godetevi l’estate finché dura!
Qual è la Prima Legge della Termodinamica?
Qual è la Seconda Legge della Termodinamica?
