Introduzione
La broncopneumopatia cronica ostruttiva (BPCO) è una causa significativa di mortalità e morbilità nel mondo moderno. Il tasso di mortalità di questa malattia è in aumento e si prevede che diventerà la terza causa di morte in tutto il mondo entro il 2020.1 Non è possibile definire la BPCO basandosi solo sul volume espiratorio forzato in 1s (FEV1), quindi la Global Initiative for Chronic Obstructive lung Disease (GOLD) ha elaborato una definizione multidimensionale per valutare la BPCO.2 La nuova definizione include la prevalenza dei sintomi e la storia precedente di esacerbazioni oltre al valore FEV1 e sottolinea anche la valutazione delle comorbidità. Per valutare i sintomi, si raccomanda il Medical Research Council (mMRC) modificato o il COPD Assessment Test (CAT). Inoltre, una scala di qualità della vita specifica per la malattia (SGRQ, SF-36, CCQ) è stata utilizzata per valutare l’impatto della malattia sulla vita quotidiana. Alcuni studi hanno dimostrato una forte relazione tra il CAT e il St. George’s Respiratory Questionnaire (SGRQ).3,4 Ladeira et al.5 hanno dimostrato che il CAT era correlato all’indice BODE.
La BPCO è una malattia complessa e comprende componenti genetiche, cellulari e molecolari. Ci sono molte cellule e molecole diverse coinvolte nelle vie infiammatorie. Diversi indicatori sono stati utilizzati per dimostrare una potenziale infiammazione sistemica legata alla malattia.6-9 L’infiammazione delle vie aeree e del parenchima polmonare è un importante meccanismo patogenetico della BPCO. Inoltre, l’infiammazione sistemica persistente può essere associata a varie comorbidità extrapolmonari ed effetti polmonari.10 Una recente ricerca ha fornito la prova dell’esistenza di un distinto “nuovo fenotipo infiammatorio sistemico della BPCO”. 7 In uno studio recente, è stato dimostrato che la comorbidità cardiovascolare e il diabete erano associati a livelli più alti per alcuni marcatori di infiammazione sistemica.11 Pertanto, il carico genetico, l’infiammazione sistemica e le malattie comorbide sono associate a vari fenotipi nella BPCO. È essenziale che si sviluppino nuove prospettive nella gestione di questa malattia.
Oggi, la TAC è stata utilizzata sempre più spesso per la valutazione e il monitoraggio della BPCO. Anche se sono stati definiti diversi biomarcatori sierici nella BPCO, non esiste un singolo biomarcatore sufficiente ed efficace che possa essere utilizzato per valutare lo stato dei pazienti con BPCO. È stato dimostrato che i biomarcatori sono associati a diversi parametri come l’infiammazione, l’ospedalizzazione e la mortalità.7-13 Tuttavia, la relazione tra CAT e biomarcatori non è stata chiaramente dimostrata. Pertanto, il presente studio ha lo scopo di indagare i livelli di infiammazione sistemica nella BPCO e determinare la relazione tra il CAT e i marcatori di infiammazione e la qualità della vita.
Materiali e metodiDisegno dello studio
Questo era uno studio osservazionale cross-sectional a visita singola. Centodieci pazienti con BPCO diagnosticata secondo i criteri GOLD14 e sessantacinque soggetti di controllo sono stati reclutati tra febbraio 2013 e agosto 2013. I soggetti di controllo sono stati scelti tra quelli indirizzati a una clinica di pneumologia e medicina interna dell’ospedale universitario di Balikesir, sottoposti a indagini di routine. Il consenso informato scritto è stato ottenuto da tutti i partecipanti e lo studio è stato approvato dal Comitato Etico Istituzionale della Facoltà di Medicina dell’Università di Balikesir.
Tutti i pazienti sono stati sottoposti a esame fisico, radiografia del torace, test di funzionalità respiratoria e analisi del sangue di routine. Il numero di esacerbazioni nell’anno precedente e la storia di fumo sono stati registrati. Il punteggio di dispnea CAT, mMRC è stato effettuato tramite interviste faccia a faccia da specialisti polmonari. I punteggi SGRQ sono stati riportati dai pazienti. Per il gruppo di controllo sano è stato fatto solo un test di funzionalità respiratoria e le analisi del sangue di routine.
La popolazione dello studio
Criteri di inclusione: I pazienti sono stati inclusi se: (1) avevano più di 40 anni; (2) erano fumatori attuali o ex-fumatori con una storia di fumo ≥10 pacchetti-anni; (3) mostravano un FEV1 post-broncodilatatore
80% e un FEV1/FVC0.7. I soggetti di controllo sono stati inclusi se: (1) avevano più di 40 anni; (2) erano esenti da malattie polmonari come determinato da un medico; (3) avevano una spirometria normale (FEV1>85% e FEV1/FVC>0.7); e (4) avevano una storia di fumo di
Criteri di esclusione: Sono stati esclusi i pazienti che: (1) hanno avuto un’esacerbazione della BPCO nelle 6 settimane precedenti; (2) hanno avuto una malattia respiratoria diversa dalla BPCO o una malattia maligna; (3) hanno avuto una malattia infiammatoria cronica (vasculite, malattia infiammatoria intestinale, artrite reumatoide ecc.) (4) aveva una malattia concomitante incontrollata o grave (MI, aritmia ecc.).
Misurazioni
Le caratteristiche demografiche, l’età, il sesso, l’abitudine al fumo, l’ammissione ad un servizio di emergenza o il ricovero nell’ultimo anno, le malattie di accompagnamento e i trattamenti esistenti sono stati tutti registrati in modo appropriato. Abbiamo definito un’esacerbazione come un peggioramento dei sintomi che ha richiesto corticosteroidi orali e/o antibiotici e/o ricovero. Le malattie comorbili sono state stabilite usando la storia clinica e i risultati dell’esame fisico durante la visita e sono state supportate da una revisione delle cartelle cliniche disponibili. Sono stati documentati i farmaci attuali, compresi gli inalatori, gli antipertensivi o altri farmaci. Sono stati misurati gli indici di altezza, peso e BMI ed è stata eseguita anche una spirometria in conformità alle linee guida internazionali (ATS/ERS).15 La malattia è stata classificata secondo la vecchia e la nuova versione della stadiazione GOLD.14 In primo luogo, la stadiazione spirometrica GOLD (stadiazione basata sul FEV1 (1-4)) e in secondo luogo, la stadiazione GOLD (classe A-D). La dispnea è stata valutata dalla scala di dispnea mMRC.16 I pazienti con BPCO sono stati categorizzati in A, B, C e D combinando la valutazione dei sintomi con i punteggi di dispnea mMRC e il rischio di esacerbazione.
CAT: La validità e l’affidabilità della versione turca di questa scala è stata precedentemente verificata.17 Il CAT include 8 item e produce punteggi totali che vanno da 0 a 40; punteggi più alti indicano una più grave compromissione dello stato di salute o un controllo meno efficace della BPCO.3
Qualità della vita Questionario: La qualità della vita è stata valutata utilizzando la traduzione turca del St. George’s Respiratory Diseases Questionnaire (SGRQ).18
Biomarcatori
Abbiamo scelto i biomarcatori sulla base di studi precedenti.7,9-13 I campioni di sangue prelevati da tutti i soggetti sono stati centrifugati e conservati a -80°C. Tutti i campioni sono stati analizzati al termine dello studio. Il siero è stato studiato in un dispositivo diagnostico (BioTek, ELx 800, USA) con l’uso di kit commerciali (eBioscience, Human TNF-α e Human IL-6 Platinum ELISA, Austria), e con i metodi della necrosi tumorale alfa (TNF-α) e un saggio di immunosorbimento legato all’enzima del livello di interleuchina-6 (IL-6) (ELISA). I livelli di proteina C-reattiva (CRP) sono stati valutati con un analizzatore di chimica clinica (Cobes Integra 800, Roche diagnostics) utilizzando un kit commerciale. Il valore di riferimento della CRP è 0-0.5mg/L, mentre il valore più basso analizzato di IL-6 è 0.92pg/ml. Il valore più basso analizzato di TNFα è 2.3pg/ml. Le concentrazioni di TNF-α e IL-6 di alcuni campioni erano inferiori al limite inferiore di quantificazione (LLQ). Nell’analisi degli individui con valori inferiori al LLQ, è stato utilizzato un livello nominale pari alla metà del valore LLQ per evitare una distorsione verso il basso dei dati della popolazione.19
Analisi statistica
I valori medi di CRP dei gruppi COPD e controllo (3.2 (1.5,7.1), 1.3 (0.6,2.7)) sono stati identificati da studi simili.7 Dopo di che, in ogni gruppo, la dimensione del campione è stata calcolata utilizzando una formula di calcolo media con l’80% di precisione e il 5% di errore. Di conseguenza, la dimensione del campione è risultata essere di almeno 55 soggetti in ogni gruppo. I risultati sono presentati come media±SD, mediana o percentuale, a seconda dei casi. Il test t di Student e l’ANOVA sono stati utilizzati per i test parametrici; il test Mann-Whitney U, Kruskal-Wallis e le statistiche chi-quadro sono stati utilizzati per i test non parametrici per i confronti tra gruppi. Il test esatto di Fisher ha valutato le differenze tra le percentuali di comorbidità e le differenze tra i sessi. Il test chi-quadrato ha valutato le differenze tra le percentuali di comorbidità. La correlazione a coppie delle variabili continue nei pazienti con BPCO è stata esaminata dalla correlazione di Pearson. Un valore di p
0,05 è stato considerato statisticamente significativo. Tutte le analisi statistiche sono state eseguite con il software SPSS (versione 20.0).RisultatiCaratterizzazione clinica dei soggetti
Lo studio ha incluso 110 pazienti (età media di 64±8,9 anni; 100 maschi (90,9%)), e 65 soggetti di controllo (età media di 61,5±9,2 anni, 55 maschi (84,6%)). Le caratteristiche demografiche e cliniche dei gruppi di pazienti e di controllo sono riportate nella tabella 1. Quarantacinque (40,9%) pazienti con BPCO avevano una malattia di accompagnamento (cardiopatia ischemica (n=21), ipertensione (n=13), diabete mellito (n=8), altro (n=3)). Il FEV1 medio era il 48,8% del valore previsto e il FEV1/FVC medio: 55,4% nel gruppo BPCO. Il punteggio CAT medio era 22,6 (±9,2), mMRC: 1,9 (±0,9) e SGRQ totale: 58,4 (±22,2). Dei 110 pazienti, il 9,1% era allo stadio 1, il 37,3% allo stadio 2, il 42,7% allo stadio 3, il 10,9% allo stadio 4 secondo la stadiazione spirometrica GOLD. Quando i pazienti sono stati classificati rispetto alla stadiazione GOLD, il 27,3% erano del gruppo A, il 30,9% del gruppo B, il 7,3% del gruppo C e il 34,5% del gruppo D.
Caratteristiche demografiche, funzionali, cliniche dei gruppi di pazienti e di controllo.
| Paziente (n=110) | Controllo (n=65) | p-value | ||
|---|---|---|---|---|
| Età | 64.0±8.9 | 61.5±9.2 | 0,080 | |
| Maschio n, (%) | 100 (90,9) | 55 (84.6) | 0,224 | |
| BMI, kg/m2 | 26,5±5,6 | 25±2,6 | 0.064 | |
| Pack-years | 38.9±23 | 0.1±1.2 | ||
| Co-morbidità, n (%) | ||||
| Qualsiasi | 65 (59.1) | 42 (64,6) | 0,95 | |
| Malattia cardiaca ischemica | 21(19,1) | 11 (16,9) | ||
| HT | 13 (11.8) | 6 (9.2) | ||
| DM | 8 (7.3) | 4 (6.2) | ||
| Altro | 3 (2.7) | 2 (3.1) | ||
| mMRC | 1.94±0.9 | 0.04±0.2 | ||
| FEV1, % previsto | 48.8±17.8 | 89.4±5.6 | ||
| FVC, % prevista | 68.7±17.8 | 92.1±5.8 | ||
| FEV1/FVC, % | 55.4±12,9 | 89,6±4,7 | ||
| stadio spirometrico GOLD, n (%) | ||||
| 1 | 10 (9.1) | |||
| 2 | 41 (37.3) | |||
| 3 | 47 (42.7) | |||
| 4 | 12 (10.9) | |||
| Stadio oro, n (%) | ||||
| A | 30 (27.3) | |||
| B | 34 (30.9) | |||
| C | 8 (7.3) | |||
| D | 38 (34.5) | |||
| punteggio totale SGRQ | 58.4±22.2 | |||
| punteggio CAT | 22.6±9.2 | |||
| TNFα (pg/ml) | 109.5±58 | 14.6±18 | ||
| IL-6 (pg/ml) | 10.3±18 | 2.14±1.9 | ||
| CRP (mg/L) | 1.6±1.7 | 0.4±0.3 | ||
Abbreviazioni: BMI, indice di massa corporea, HT: ipertensione, DM: diabete, FEV1: volume espiratorio forzato in 1 secondo, FVC: capacità vitale forzata, CAT: Test di valutazione della BPCO.
Confronti BPCO/controllo
Non ci sono state differenze significative tra le età (p=0,080, test t di Student) e i sessi dei due gruppi (p=0,453, test esatto di Fisher) (Tabella 1). I gruppi presentavano incidenze simili di comorbidità (p=0,095, test χ2). Come previsto, i pazienti con BPCO avevano parametri di funzione polmonare significativamente più bassi (FEV1, FVC, FEV1/FVC) rispetto ai controlli (p
0.001, test t di Student). In generale, i pazienti con BPCO hanno mostrato livelli sierici più alti di CRP (1,6±1,7mg/L) e TNF-α (109,5±58pg/ml) e IL-6 (10,3±18pg/ml) rispetto ai controlli sani (CRP: 0,4±0,3mg/L, p0,001; TNF-α: 14.6±18pg/ml, p0.001; IL-6: 2.14±1.9pg/ml, p0.001, test t di Student) (Tabella 1).Associazione dei questionari CAT e caratteristiche dei pazienti
C’era una correlazione tra il punteggio CAT e lo stadio spirometrico GOLD (r di Pearson=0.43; p
0.001). Il punteggio CAT è aumentato parallelamente alla gravità della malattia. C’era una relazione statisticamente significativa tra il punteggio CAT e il numero di esacerbazioni nell’anno precedente (r=0,35 di Pearson, p0,001), la durata della malattia (r=0,29 di Pearson, p0,001), il fumo (pacchetto-anno) (r=0,27 di Pearson, p=0,014) e il mMRC (r=0,59 di Pearson, p0,001). Il punteggio CAT è stato trovato significativamente correlato con FEV1 (r=-0,39 di Pearson, p0,001) e FVC (r=-42 di Pearson, p=0,003). Allo stesso tempo, è stata osservata una forte correlazione tra il punteggio CAT e i punteggi SGRQ di sintomi, attività, impatto e totale (r=0,72 di Pearson; p0,001).Associazione tra biomarcatori e caratteristiche del paziente
Sono stati confrontati i marcatori infiammatori e i parametri di funzionalità polmonare. Man mano che il FEV1 diminuiva, i livelli di biomarcatore aumentavano significativamente. I livelli di CRP erano correlati a FEV1 (r=-0,39 di Pearson, p
0,001), FVC (r=-0,33 di Pearson, p0,001) e FEV1/FVC (r=-0,38 di Pearson, p0,001). I livelli di TNF-α erano anche correlati con FEV1 (r=-0,57 di Pearson, p0,001), FVC (r=-0,37 di Pearson, p0,001) e FEV1/FVC (r=-0,66 di Pearson, p0,001). I livelli di IL-6 erano anche correlati con FEV1 (r=-0,31 di Pearson, p0,001), FVC (r=-0,32 di Pearson, p0,001) e FEV1/FVC (r=-0,34 di Pearson, p0,001). Una correlazione significativa è stata osservata tra CRP, TNF-α, IL-6 e fumo (pacchetto-anno) (r=0,35 di Pearson, r=0,44, r=0,27, p0,001, rispettivamente). I pazienti BPCO con malattia cardiovascolare avevano un livello aumentato di CRP (2,98±2.4mg/L) rispetto ai pazienti senza comorbidità (1,56±1,5mg/L, p=0,008 test ANOVA seguito da LSD post hoc test). Non c’era alcuna associazione significativa con altri biomarcatori e comorbidità. Quando l’IL-6 aumentava, il punteggio mMRC aumentava, ma questa relazione non era statisticamente significativa (p=0,06). Quando i marcatori infiammatori sono stati confrontati con il punteggio CAT, i livelli di CRP hanno mostrato di avere una correlazione significativa (r=0,43, p0,001) (Fig. 1) mentre nessuna correlazione è stata osservata con TNF-α e IL-6. C’era una correlazione tra i livelli di CRP e TNFα (r=0,48, p0,001). Nessuna associazione diretta è stata osservata tra i biomarcatori e la classe A-D o gli stadi spirometrici.
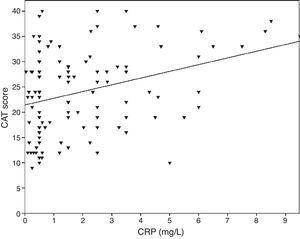
La relazione tra i punteggi CAT e CRP (r=0.43, p0.001).
Discussione
Alcuni strumenti di valutazione sono utilizzati come test clinici (CAT, BODE), marcatori di infiammazione e questionari sulla qualità della vita per valutare la BPCO. È comunemente accettato che una valutazione multidimensionale è necessaria per comprendere e gestire la malattia. La BPCO è un disturbo complesso con una componente sistemica e alcuni pazienti sembrano avere un fenotipo infiammatorio. In questo studio, la CAT è stata eseguita come un nuovo test clinico, e la relazione della CAT con altre componenti della BPCO è stata indagata.
Una di queste componenti è l’infiammazione sistemica. I biomarcatori più spesso studiati nella BPCO per indicare l’infiammazione sistemica che sono comunemente usati sono CRP, IL-6, TNF-α, IL-8 e fibrinogeno. Diversi studi hanno precedentemente riportato elevati livelli circolanti di questi marcatori in pazienti con BPCO stabile.6-9,20-23 In uno studio recente, Agustí et al. hanno dimostrato che il 30% dei pazienti con BPCO non presentava prove di infiammazione sistemica e il 16% dei pazienti presentava un’infiammazione sistemica persistente.7 È interessante notare che in questo studio, i livelli sierici di TNF-α e IL-8 sono risultati più alti nei fumatori con spirometria normale rispetto ai pazienti con BPCO. Gli altri marcatori come globuli bianchi, IL-6, CRP e fibrinogeno sono stati trovati più alti nei pazienti con BPCO che nei fumatori con spirometria normale e nei non fumatori. Nel nostro studio, i livelli di CRP, TNF-α, IL-6 erano significativamente più alti in tutti i pazienti BPCO rispetto al gruppo di controllo. Tutti i biomarcatori sono stati trovati correlati all’esposizione cumulativa al fumo e alla riduzione dei parametri dei test di funzionalità polmonare (FEV1, FVC e FEV1/FVC). Il livello dei biomarcatori è correlato al grado di ostruzione del flusso aereo. Questi risultati sono coerenti con quelli riportati in precedenti studi trasversali.13 In un altro studio che ha esaminato i risultati di ECLIPSE, le comorbidità cardiovascolari e il diabete erano correlati con alcuni marcatori di infiammazione sistemica.9 Nel nostro studio, i pazienti con BPCO con malattia cardiovascolare avevano un livello aumentato di CRP rispetto ai pazienti senza comorbidità. L’aumento dell’infiammazione sistemica nella BPCO con malattie cardiovascolari supporta un meccanismo fisiopatologico tra la BPCO e queste comorbidità.
La relazione tra CAT e infiammazione sistemica non è stata chiarita dagli studi condotti finora. In uno studio, è stata dimostrata una correlazione significativa tra LCN1, LCN2 e CAT.8 Nel nostro studio, è stata dimostrata una relazione significativa tra CAT e CRP. Tuttavia, una simile correlazione non ha potuto essere mostrata con TNF-α e IL-6.
Nel presente studio, i pazienti con BPCO sono stati classificati in quattro gruppi (A-D) e stadi (1-4) secondo la vecchia e la nuova versione della classificazione GOLD. Si può osservare che lo stadio 1 e lo stadio 4 costituiscono la proporzione più piccola della popolazione con il 10% ciascuno secondo la vecchia classificazione. Nella nuova versione, la popolazione era distribuita quasi equamente tra i gruppi A, B e D; la distribuzione più piccola era quella del gruppo C. In altri studi, è stato anche dimostrato che il gruppo C costituisce la proporzione più piccola della distribuzione.24,25 La nuova classificazione indica che ci possono essere alcuni pazienti con più sintomi ma con una lieve ostruzione delle vie aeree così come alcuni pazienti con pochi sintomi ma con gravi ostruzioni delle vie aeree. Le comorbilità e l’infiammazione sistemica possono portare ad un aumento delle esacerbazioni e dei sintomi nei pazienti con ostruzione lieve/moderata, e in questo modo, fa sì che questi pazienti siano collocati nei gruppi ad alto rischio (classe C o D). In uno studio, è stato dimostrato che il sottotipo C comprende i pazienti con uno stato di comorbidità più elevato e il sottotipo D comprende i pazienti con le esacerbazioni più gravi, un alto tasso di esacerbazioni legate all’ospedalizzazione e gli esiti più poveri.26 In uno studio recente, Agustí et al. hanno confrontato due gruppi con e senza infiammazione sistemica persistente e hanno dimostrato che i pazienti che presentavano un’infiammazione persistente durante il follow-up avevano tassi di esacerbazione all’anno maggiori rispetto all’altro gruppo, sebbene le anomalie polmonari fossero simili in questi due gruppi.7
GOLD raccomanda l’uso della scala CAT o mMRC per valutare i sintomi. Abbiamo usato la scala mMRC per l’assegnazione del gruppo, perché quando abbiamo considerato i sintomi sulla base del CAT, il numero dei pazienti con meno di 10 punti di rottura era molto piccolo (8 pazienti). I punteggi CAT più alti possono essere associati alla maggiore percezione dei sintomi dei pazienti. È stato anche dimostrato che CAT e mMRC non sono equivalenti, e questo può causare alcune differenze nella classificazione.24,25,27 Nella nuova classificazione, gli altri cut-off points sono composti dal numero di esacerbazioni per anno. La relazione tra il punteggio CAT al basale e la frequenza delle esacerbazioni è stata dimostrata nei pazienti con BPCO.28 Pothirat et al. hanno dimostrato che il cambiamento del punteggio CAT durante le visite di monitoraggio è uno strumento utile per rilevare il deterioramento acuto dello stato di salute dei pazienti con BPCO.29 Nel nostro studio, è stata osservata una forte relazione tra CAT, mMRC e i tassi di esacerbazione. Il CAT è stato anche trovato correlato alla durata della malattia e al fumo (pacchetto-anno). Il FEV1 medio dei pazienti è stato trovato al 48,8% del valore previsto e il punteggio medio del CAT era di 22,6. È stata dimostrata una forte associazione tra CAT e FEV1, FVC e lo stadio spirometrico GOLD. Man mano che il FEV1 e il FVC diminuivano, il punteggio CAT aumentava. Il punteggio CAT era anche correlato positivamente con uno stadio GOLD più pesante. Questi risultati mostrano che il CAT riflette molto bene la gravità della malattia.
Un’altra componente importante della gestione della BPCO è la qualità della vita. Una varietà di questionari sulla vita sono stati usati per valutare gli effetti della malattia sulla vita quotidiana. L’affidabilità e la validità della versione turca dell’SGRQ sono state dimostrate.30 Alcuni studi hanno dimostrato che è stata osservata una correlazione significativa tra il CAT e l’SGRQ.3,4 In uno studio, è stato riportato che il CAT è sensibile al cambiamento dello stato di salute associato alle esacerbazioni della BPCO.31 Nel nostro studio, è stata dimostrata una forte relazione tra il CAT e l’SGRQ. Poiché il CAT, rispetto all’SGRQ, è un test più breve e più facile da capire, l’uso del CAT è più pratico.
Il presente studio ha diverse limitazioni, come il disegno trasversale, uno studio in un solo centro e una piccola dimensione del campione. Inoltre, i marcatori di infiammazione non potevano essere confrontati nei fumatori che hanno una funzione polmonare normale perché non sono stati inclusi nel presente studio. I farmaci per i pazienti possono esercitare un’influenza sulla risposta infiammatoria sistemica e lo stato di salute e possono anche influenzare i risultati.
In sintesi, la CAT è un test che può essere utilizzato nella valutazione della BPCO, poiché la sua affidabilità e validità sono state chiaramente dimostrate. I risultati del nostro studio indicano la relazione tra CAT e CRP così come altri componenti della BPCO (parametri clinici e funzionali). Tuttavia, sono necessari studi longitudinali multicentrici per valutare la relazione tra CAT e biomarcatori.
Discrezioni eticheProtezione dei soggetti umani e animali
Gli autori dichiarano che nessun esperimento è stato eseguito su esseri umani o animali per questo studio.
Confidenzialità dei dati
Gli autori dichiarano di aver seguito i protocolli del loro centro di lavoro sulla pubblicazione dei dati dei pazienti e che tutti i pazienti inclusi nello studio hanno ricevuto informazioni sufficienti e hanno dato il loro consenso informato scritto per partecipare allo studio.
Diritto alla privacy e consenso informato
Gli autori hanno ottenuto il consenso informato scritto dei pazienti o dei soggetti menzionati nell’articolo. L’autore corrispondente è in possesso di questo documento.
Autore
Disegno dello studio: NS, FE e AAH; Raccolta dei dati: NS, CB; Analisi dei dati e interpretazione: NS, AAH e CB; Revisione critica del manoscritto: NS, FE, CB e AAH.
Conflitti di interesse
Gli autori dichiarano di non avere conflitti di interesse nella preparazione di questo manoscritto.
