Quick Takes
- I ponti miocardici sono comuni e generalmente benigni.
- Esercizio e tachicardia possono provocare sintomi e ischemia.
- Il piano di trattamento ottimale dovrebbe essere basato sui sintomi, la presenza di ischemia documentata e gli obiettivi dell’atleta.
Presentazione del caso
Un vogatore maschio di 66 anni con una storia di ipertensione e dislipidemia ha presentato con dolore toracico da sforzo e palpitazioni. Ha negato sintomi o limitazioni nelle attività della vita quotidiana. Si è impegnato in esercizio vigoroso ogni giorno e il suo obiettivo era quello di continuare la sua attuale routine di esercizio senza restrizioni di esercizio.
Si è sottoposto a un test da sforzo massimale che ha dimostrato l’ectopia ventricolare crescente e corse di tachicardia ventricolare non sostenuta (NSVT) a carichi di lavoro più elevati (Figura 1). Un ecocardiogramma ha rivelato una normale frazione di eiezione ventricolare sinistra (LVEF) del 65% con una dimensione diastolica di fine ventricolo sinistro di 50 mm e spessore della parete settale e posteriore di 12 mm e 11 mm, rispettivamente.
Figura 1

Figura 1

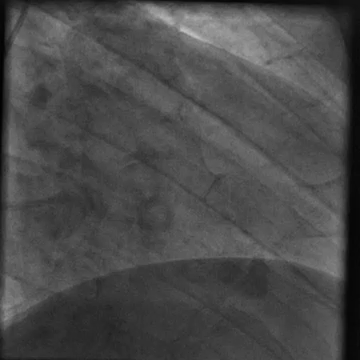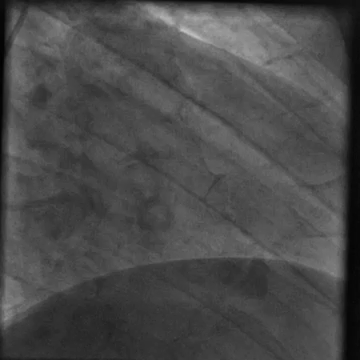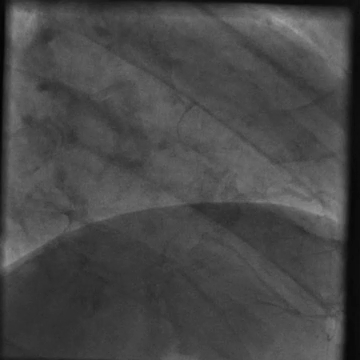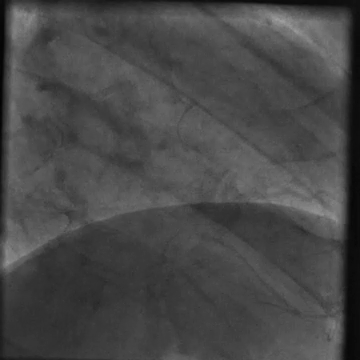
È stato indirizzato per un angiogramma coronarico (Video 1) e sottoposto a infusione intracoronarica di dobutamina (Video 2) che ha riprodotto i suoi sintomi di dolore al petto e palpitazioni, queste ultime correlate a salvataggi di tachicardia ventricolare.
Video 1
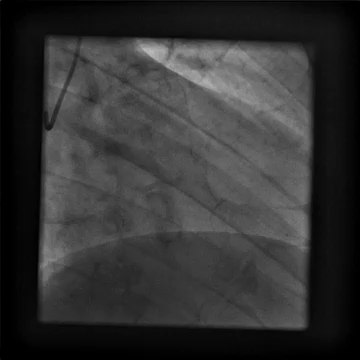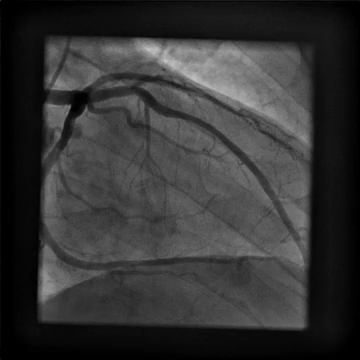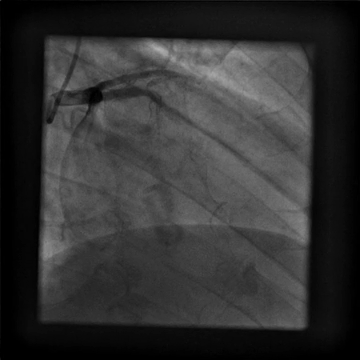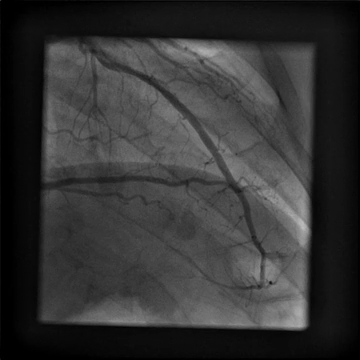
Video 1

Video 2
Video 2

Ponte miocardico
Il ponte miocardico si verifica quando una porzione di un’arteria coronaria epicardica prende un corso intramuscolare e viene scavata sotto un ponte muscolare sovrastante.1 Questa anomalia coronarica congenita si traduce in una compressione sistolica della porzione di arteria coronaria in galleria e rimane clinicamente silenziosa nella maggior parte dei casi. Mentre qualsiasi arteria epicardica può essere interessato, bridging del segmento medio della sinistra anteriore discendente (LAD) è più comune.2
La prevalenza di ponti miocardici varia notevolmente in base alla tecnica utilizzata per identificare l’anomalia. La prevalenza in studi autoptici sono stati segnalati fino a 86%,3 con una media del 25% simile a valutazioni più recenti utilizzando angiografia tomografia computerizzata coronarica (CCTA).4 Al contrario, la prevalenza di ponti miocardici riportati da angiografia coronarica è inferiore a studi autoptici e CCTA, che vanno da 0,5 a 16%, e rimane ≤40% con l’uso di test provocatorio.3 C’è un’alta prevalenza (41%) di bridging miocardico negli adulti con cardiomiopatia ipertrofica (HCM).5 Le differenze di prevalenza in base alla modalità diagnostica utilizzata evidenziano l’importanza di differenziare un reperto funzionale significativo da un reperto anatomico.
Patofisiologia
C’è evidenza di una formazione accelerata della placca aterosclerotica che si sviluppa prossimalmente al segmento bridged ma risparmia il segmento tunneled.6 L’aumento della tensione e dello stiramento della parete locale può indurre lesioni endoteliali e contribuire alla formazione della placca aterosclerotica prossimale.7,8 Tuttavia, questa placca prossimale fissa non è probabilmente l’unico meccanismo di ischemia miocardica in questi pazienti.6 Utilizzando l’angiografia coronarica quantitativa frame-by-frame, è stato dimostrato che la compressione dei vasi delle arterie a ponte si estende in diastole con conseguente diminuzione della perfusione coronarica.9,10 Combinando le misurazioni di flusso e pressione doppler intracoronarica con l’angiografia coronarica, è stata dimostrata l’evidenza di una diminuzione persistente del diametro diastolico dei vasi e una ridotta riserva di flusso nei pazienti con ponti sintomatici.7 Dato questo, è probabile che l’ischemia sia provocata dalla tachicardia e dall’aumento della contrattilità durante lo stress o l’esercizio, con conseguente diminuzione del tempo di riempimento diastolico delle coronarie, compromissione del flusso sanguigno coronarico e peggioramento della compressione sistolica e diastolica dell’arteria.3 Gli studi patologici suggeriscono che i vasi a ponte che sono lunghi e più profondi di 3 mm sotto l’epicardio sono ad alto rischio di eventi cardiaci.11
Presentazione clinica
I ponti miocardici sono stati associati ad angina da sforzo, ischemia miocardica, sindromi coronariche acute, aritmie ventricolari, cardiomiopatia da stress e morte cardiaca improvvisa.2 Tuttavia, queste complicazioni sono rare e la maggior parte dei ponti miocardici sono benigni e non hanno significato clinico. I pazienti precedentemente asintomatici possono sviluppare sintomi con lo sviluppo di disfunzione diastolica, ipertrofia ventricolare sinistra, vasospasmo coronarico o disfunzione microvascolare.2 Inoltre, i sintomi e l’ischemia possono essere provocati dall’esercizio fisico e dalla tachicardia.
Diagnosi
Una varietà di modalità diagnostiche sono utilizzate per indagare il significato anatomico e fisiologico del ponte miocardico. La CCTA può essere uno strumento prezioso per valutare l’anatomia miocardica e può fornire informazioni strutturali sui ponti miocardici. Tuttavia, sono necessari test successivi per valutare la rilevanza funzionale dei risultati sulla CCTA. Pertanto, l’angiografia coronarica è comunemente utilizzata per fornire una valutazione strutturale e funzionale del ponte. I risultati tipici includono un restringimento sistolico o “mungitura” dell’arteria epicardica e un fenomeno “step down-step up” che aiuta a identificare il segmento tunnelato. Quando la diagnosi angiografica rimane incerta, l’ecografia intravascolare (IVUS) si è dimostrata superiore nel rilevare i ponti.6 La riserva di flusso frazionale (FFR) può essere utilizzata per valutare meglio l’impatto fisiologico dei ponti miocardici. Data la fisiopatologia, la provocazione con dobutamina è preferita all’adenosina, e le misurazioni diastoliche della FFR dovrebbero essere misurate invece della FFR media.12,13 Inoltre, la nitroglicerina intracoronarica può essere utilizzata per accentuare il restringimento sistolico del segmento bridged, poiché vasodilaterà i segmenti coronarici adiacenti non bridged.14
Trattamento
L’evidenza dietro la terapia medica nel bridging miocardico è limitata. I nitrati sono controindicati in quanto possono accentuare la compressione sistolica del segmento bridging vasodilatando i segmenti coronarici adiacenti non bridged e peggiorare i sintomi.6 I calcio-antagonisti possono essere utili se il vasospasmo è presente. Si ritiene che i beta-bloccanti allevino i disturbi emodinamici diminuendo il picco della frequenza cardiaca, aumentando il tempo di riempimento diastolico e diminuendo la contrattilità e la compressione dell’arteria.15 Di conseguenza, sono comunemente usati come agenti di prima linea per i pazienti con sintomi.
L’intervento coronarico percutaneo (PCI) per il bridging refrattario alla terapia medica è stato riportato per la prima volta nel 1995.16 Originariamente pensato per risolvere le anomalie emodinamiche e i sintomi, il PCI per il bridging miocardico ha portato ad alti tassi di rivascolarizzazione delle lesioni bersaglio6 e a preoccupazioni di frattura dello stent, trombosi dello stent e perforazione coronarica. L’utilità di questo approccio è quindi molto limitata e non raccomandata.
I due approcci chirurgici più comuni sono l’innesto di bypass coronarico (CABG) e la miotomia chirurgica. Data la preoccupazione del fallimento dell’innesto, il CABG sembra essere più vantaggioso nei ponti miocardici lunghi (>25 mm) o profondi (>5 mm).2 In assenza di ponti lunghi o profondi, dovrebbe essere considerata la miotomia chirurgica. La miotomia chirurgica comporta la resezione delle fibre muscolari sovrastanti del ponte miocardico e ha dimostrato di aumentare il flusso sanguigno coronarico ed eliminare i sintomi.6
Considerazioni specifiche per gli atleti
Data la rarità degli eventi cardiaci nonostante l’alta prevalenza di ponti miocardici su studi autoptici e CCTA, i fornitori dovrebbero essere cauti nell’attribuire i sintomi cardiaci negli atleti a un ponte miocardico.17 Questo può essere particolarmente vero negli atleti master che hanno partecipato a sport competitivi per anni senza incidenti e sono sopravvissuti alla prova del tempo. Tuttavia, l’ipertensione e il conseguente sviluppo dell’ipertrofia ventricolare sinistra possono aumentare la compressione coronarica e ridurre la riserva microvascolare coronarica e fornire una potenziale spiegazione del perché si possa diventare sintomatici più tardi nella vita.2
Le attuali raccomandazioni suggeriscono che gli atleti con ponte miocardico e nessuna evidenza di ischemia durante il test da sforzo massimale possono partecipare a tutti gli sport competitivi.11 Negli atleti sintomatici, l’inizio dei beta-bloccanti insieme al test da sforzo periodico per valutarne l’efficacia può essere efficace. Tuttavia, l’esercizio vigoroso può aumentare il rischio di eventi cardiaci avversi in quelli con ponti miocardici sintomatici e ischemia documentata, quindi un approccio chirurgico può essere vantaggioso negli atleti che desiderano tornare alla piena partecipazione. In definitiva, in assenza di studi clinici per guidare il piano di trattamento ottimale, si raccomanda un approccio decisionale condiviso.
Caso di follow-up
Il nostro paziente è stato trovato per avere un ponte miocardico LAD medio emodinamicamente significativo con stenosi del 75% durante la sistole in condizioni di riposo. Dato il suo obiettivo di tornare all’allenamento intenso senza restrizioni e chiara evidenza di ischemia con infusione di dobutamina, è stato raccomandato di sottoporsi a miotomia chirurgica. Ha tollerato bene la procedura. La ripetizione del test da sforzo ha rivelato una risposta cardiovascolare adeguata all’esercizio senza ectopia ventricolare, ischemia o dolore toracico. Rimane asintomatico e viene seguito senza restrizioni di esercizio.
- Angelini P, Velasco JA, Flamm S. Anomalie coronariche: incidenza, fisiopatologia e rilevanza clinica. Circolazione 2002;105:2449-54.
- Corban MT, Hung OY, Eshtehardi P, et al. Myocardial bridging: comprensione contemporanea della fisiopatologia con implicazioni per strategie diagnostiche e terapeutiche. J Am Coll Cardiol 2014;63:2346-55.
- Möhlenkamp S, Hort W, Ge J, Erbel R. Aggiornamento sul bridging miocardico. Circulation 2002;106:2616-22.
- Konen E, Goitein O, Sternik L, Eshet Y, Shemesh J, Di Segni E. La prevalenza e modelli anatomici delle arterie coronarie intramuscolari. J Am Coll Cardiol 2007;49:587-93.
- Basso C, Thiene G, Mackey-Bojack S, Frigo AC, Corrado D, Maron BJ. Il bridging miocardico, una componente frequente del fenotipo della cardiomiopatia ipertrofica, manca di associazione sistematica con la morte cardiaca improvvisa. Eur Heart J 2009;30:1627-34.
- Lee MS, Chen C-H. Il bridging miocardico: una revisione aggiornata. J Invasive Cardiol 2015;27:521-8.
- Klues HG, Schwarz ER, vom Dahl J, et al. Disturbata emodinamica intracoronarica in bridging miocardico: normalizzazione precoce da posizionamento stent intracoronarico. Circolazione 1997;96:2905-13.
- Ge J, Erbel R, Görge G, Haude M, Meyer J. Alto stress di taglio della parete prossimale al miocardio bridging e aterosclerosi: ultrasuoni intracoronarico e misure di pressione. Br Heart J 1995;73:462-5.
- Ge J, Erbel R, Rupprecht HJ, et al. Confronto di ultrasuoni intravascolari e angiografia nella valutazione del bridging miocardico. Circolazione 1994;89:1725-32.
- Erbel R, Rupprecht H-J, Ge J, Gerber T, Görge G, Meyer J. Forma dell’arteria coronaria e cambiamenti di flusso indotti dal bridging miocardico: valutazione da ultrasuoni intravascolare. Ecocardiografia 1993;10:71-7.
- Thompson PD, Myerburg RJ, Levine BD, Udelson JE, Kovacs RJ. Raccomandazioni di eleggibilità e squalifica per atleti competitivi con anomalie cardiovascolari: Task Force 8: malattia coronarica: una dichiarazione scientifica dell’American Heart Association e American College of Cardiology. J Am Coll Cardiol 2015;66:2406-11.
- Escaned J, Cortés J, Flores A, et al. Importanza della riserva di flusso frazionale diastolica e sfida dobutamina nella valutazione fisiologica del bridging miocardico. J Am Coll Cardiol 2003;42:226-33.
- Hakeem A, Cilingiroglu M, Leesar MA. Valutazione emodinamica ed ecografica intravascolare del bridging miocardico: paradosso della riserva di flusso frazionale con dobutamina rispetto all’adenosina. Catheter Cardiovasc Interv 2010;75:229-36.
- Hongo Y, Tada H, Ito K, Yasumura Y, Miyatake K, Yamagishi M. Aumento della compressione del vaso al ponte coronarico-miocardico da nitroglicerina: studio di angiografia coronarica quantitativa e ultrasuoni intravascolare. Am Heart J 1999;138:345-50.
- Schwarz ER, Klues HG, vom Dahl J, Klein I, Krebs W, Hanrath P. Caratteristiche funzionali, angiografiche e intracoronarica Doppler flusso in pazienti sintomatici con bridging miocardico: effetto di breve termine endovena beta-bloccante farmaco. J Am Coll Cardiol 1996;27:1637-45.
- Stabili RH, Knight CJ, McNeill JG, Sigwart U. Stenting coronarico nella gestione dell’ischemia miocardica causata dal bridging muscolare. Br Heart J 1995;74:90-2.
- Gowd BMP, Thompson PD. Isolato miocardico bridging e gli eventi cardiaci legati all’esercizio. Int J Sports Med 2014;35:1145-50.
Temi clinici: Sindromi coronariche acute, aritmie e EP clinica, insufficienza cardiaca e cardiomiopatie, angiografia cardiovascolare invasiva e intervento, imaging non invasivo, cardiologia dello sport e dell’esercizio fisico, cardiopatia ischemica stabile, scienza di base EP, SCD/aritmie ventricolari, interventi e ACS, Interventi e imaging, Interventi e cardiopatia strutturale, Angiografia, Imaging nucleare, Sport ed esercizio fisico e cardiopatia congenita e cardiologia pediatrica, Sport ed esercizio fisico ed ECG e test da sforzo, Sport ed esercizio fisico e imaging, Angina cronica
Parole chiave: Sport, bridging miocardico, dobutamina, angiografia coronarica, complessi prematuri ventricolari, diastole, sistole, vasospasmo coronarico, test da sforzo, placca, aterosclerotica, autopsia, volume di colpo, prevalenza, carico di lavoro, attività della vita quotidiana, Sindrome coronarica acuta, Calcioantagonisti, Nitroglicerina, Nitrati, Angiografia coronarica, Intervento coronarico percutaneo, Ipertrofia, Ventricolo sinistro, Costrizione, Patologico, Adenosina, Processo decisionale
< Torna agli annunci
