Il termine stereochimico diastereotopico si riferisce alla relazione tra due gruppi in una molecola che, se sostituiti, genererebbero composti che sono diastereomeri. I gruppi diastereotopici sono spesso, ma non sempre, gruppi identici attaccati allo stesso atomo in una molecola contenente almeno un centro chirale.
Per esempio, i due atomi di idrogeno della parte CH2 in (S)-2-bromobutano sono diastereotopici. La sostituzione di un atomo di idrogeno (colorato in blu) con un atomo di bromo produrrà (2S,3R)-2,3-dibromobutano. La sostituzione dell’altro atomo di idrogeno (colorato in rosso) con un atomo di bromo produrrà il diastereomero (2S,3S)-2,3-dibromobutano.
 |
 |
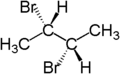 |
| (S)-2-bromobutano | (2S,3R)-2,3-dibromobutane | (2S,3S)-2,3-dibromobutano |
Nelle molecole chirali che contengono gruppi diastereotopici, come nel 2-bromobutano, non ci sono requisiti di purezza enantiomerica o ottica; indipendentemente dalla sua proporzione, ogni enantiomero genererà insiemi enantiomerici di diastereomeri al momento della sostituzione dei gruppi diastereotopici (anche se, come nel caso della sostituzione con bromo nel 2-bromobutano, gli isomeri meso non hanno, a rigore, alcun enantiomero).
I gruppi diastereotopici non sono immagini speculari l’uno dell’altro su qualsiasi piano. Sono sempre diversi, in qualsiasi ambiente, ma possono non essere distinguibili. Per esempio, entrambe le coppie di idrogeni CH2 nell’etil fenilalaninato cloridrato (PhCH2CH(NH3+)COOCH2CH3 Cl-) sono diastereotopici ed entrambi danno coppie di segnali 1H-NMR distinti in DMSO-d6 a 300 MHz, ma nel simile etil 2-nitrobutanoato (CH3CH2CH(NO2)COOCH2CH3), solo il gruppo CH2 vicino al centro chirale dà segnali distinti dai suoi due idrogeni con lo stesso strumento in CDCl3. Tali segnali sono spesso complessi a causa di piccole differenze di spostamento chimico, sovrapposizione e un ulteriore forte accoppiamento tra gli idrogeni geminali. D’altra parte, i due gruppi CH3 dell’ipsenolo, che sono a tre legami dal centro chirale, danno doppietti 1H separati a 300 MHz e segnali 13C-NMR separati in CDCl3, ma gli idrogeni diastereotopici nell’etil alaninato cloridrato (CH3CH(NH3+)COOCH2CH3 Cl-), anche loro a tre legami dal centro chirale, mostrano segnali 1H-NMR appena distinguibili in DMSO-d6.

Gruppi diastereotopici sorgono anche in molecole acirali. Per esempio, una qualsiasi coppia di idrogeni CH2 nel 3-pentanolo (Figura 1) sono diastereotopici, poiché i due carboni CH2 sono enantiotopici. La sostituzione di uno qualsiasi dei quattro idrogeni CH2 crea due centri chirali contemporaneamente, e i due possibili prodotti di sostituzione dell’idrogeno a qualsiasi carbonio CH2 saranno diastereomeri. Questo tipo di relazione è spesso più facile da rilevare nelle molecole cicliche. Per esempio, qualsiasi coppia di idrogeni CH2 nel ciclopentanolo (Figura 2) sono similmente diastereotopici, e questo è facilmente distinguibile in quanto uno degli idrogeni della coppia sarà cis al gruppo OH (sullo stesso lato della faccia dell’anello) mentre l’altro sarà trans ad esso (sul lato opposto).
Il termine diastereotopico si applica anche a gruppi identici attaccati alla stessa estremità di una parte alchenica che, se sostituiti, genererebbero isomeri geometrici (anch’essi rientranti nella categoria dei diastereomeri). Così, gli idrogeni CH2 del propene sono diastereotopici, uno essendo cis al gruppo CH3, e l’altro essendo trans ad esso, e la sostituzione dell’uno o dell’altro con CH3 genererebbe cis- o trans–2-butene.

La diastereotopicità non è limitata alle molecole organiche, né ai gruppi attaccati al carbonio, né alle molecole con centri tetraedrici chirali (sp3-ibridizzati): per esempio, la coppia di idrogeni in qualsiasi gruppo CH2 o NH2 nello ione tris(etilendiammina)cromo(III) (Cr(en)33+), dove il centro metallico è chirale, sono diastereotopici (Figura 2).
I termini enantiotopico e diastereotopico possono anche essere applicati alle facce di gruppi planari (specialmente gruppi carbonilici e alcheni). Vedi la regola di priorità Cahn-Ingold-Prelog.
