US Pharm. 2020;45(5)(Specialty&Oncology suppl):3-8.
ABSTRACT: Negli ultimi anni, diverse nuove opzioni terapeutiche mirate sono state sviluppate per combattere la resistenza alla terapia endocrina tradizionale per il cancro al seno avanzato. Tre inibitori CDK4/6 (palbociclib, ribociclib e abemaciclib) sono stati approvati per pazienti con carcinoma mammario avanzato positivo al recettore ormonale e negativo al recettore 2 del fattore di crescita epidermico umano. Ogni agente ha dimostrato la sua efficacia, ma esistono differenze tra i tre farmaci, in particolare nei loro profili di eventi avversi.
Il cancro al seno è il tipo più comune di cancro nelle donne, con più di 276.000 nuovi casi stimati nel 2020.1 Il cancro al seno positivo al recettore ormonale (HR+), che rappresenta più del 70% di questi casi, storicamente è stato trattato con la terapia endocrina (ET), come gli inibitori selettivi del recettore degli estrogeni e gli inibitori dell’aromatasi (AIs). Anche se l’ET rimane la spina dorsale del trattamento del cancro al seno HR+, la resistenza si sviluppa fino al 50% delle pazienti con cancro al seno avanzato.2 Per combattere la resistenza, sono state approvate terapie mirate per il cancro al seno HR+.3,4
Gli inibitori della chinasi ciclina-dipendente (CDK), la classe più recente di interesse per il cancro al seno avanzato, funzionano inibendo specificamente le proteine CDK4/6 e bloccando la transizione dalla fase G1 alla fase S del ciclo cellulare. Questa classe di farmaci inibisce l’attività della chinasi, che fosforila il percorso della proteina retinoblastoma. Bloccando questo percorso, gli inibitori CDK4/6 sono in grado di bloccare la progressione del ciclo cellulare a metà della fase G1 e prevenire la progressione delle cellule tumorali. Negli ultimi anni, tre inibitori di CDK4/6 (palbociclib, ribociclib e abemaciclib) sono stati approvati come terapie combinate per i tumori al seno HR+, recettore del fattore di crescita epidermico umano 2-negativi (HER2-), avanzati o metastatici.5-8 Questo articolo esamina le differenze tra questi agenti (TABELLA 1), gli studi clinici di fase III (TABELLA 2) e i profili degli eventi avversi (AE) (TABELLA 3).
Palbociclib
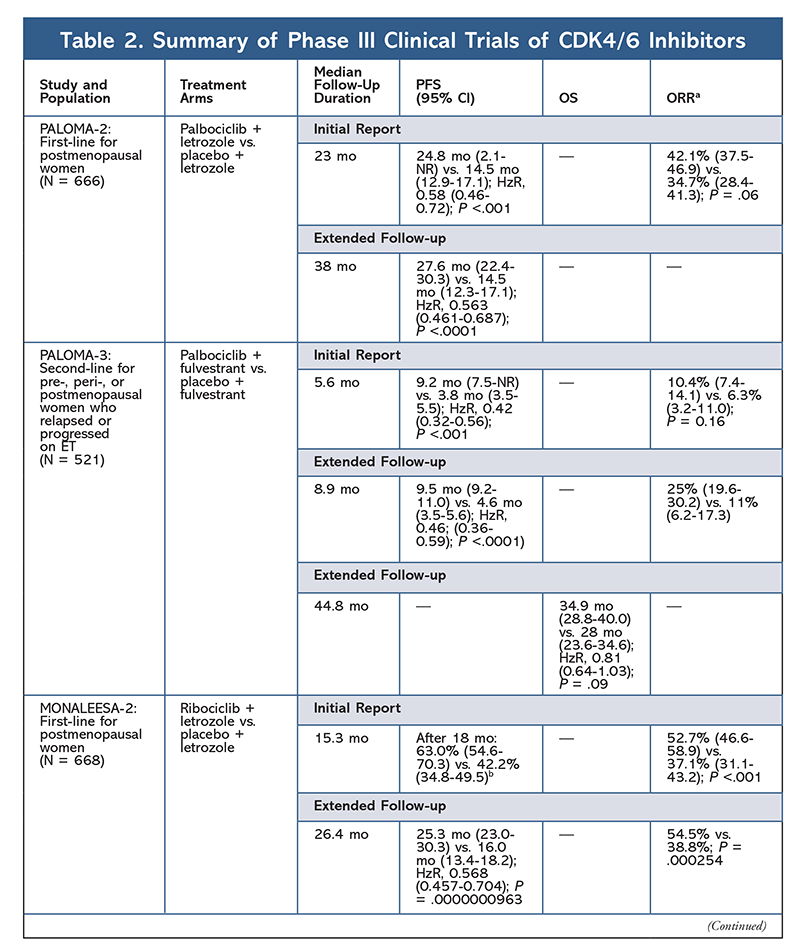
Nel 2015, palbociclib è diventato il primo inibitore CDK4/6 a ricevere l’approvazione della FDA per il trattamento del cancro al seno HR+, HER2- (in combinazione con un AI come ET iniziale nelle donne in postmenopausa o negli uomini, o in combinazione con fulvestrant in pazienti con progressione della malattia dopo ET).6,9-14 Palbociclib ha inizialmente ricevuto l’approvazione dopo i risultati positivi dello studio di fase II PALOMA-1, che ha confrontato palbociclib più letrozolo con letrozolo da solo come terapia iniziale per le pazienti con tumore al seno avanzato naive a ET.9
Questi risultati hanno portato a due studi di fase III per valutare ulteriormente l’effetto di palbociclib in questa popolazione di pazienti. I risultati iniziali di PALOMA-2 hanno confermato gli effetti di palbociclib più letrozolo, dimostrando una migliore sopravvivenza libera da progressione (PFS) rispetto al solo letrozolo (24,8 mesi contro 14,5 mesi, rispettivamente; hazard ratio per progressione della malattia o morte, 0,58; 95% CI, 0,46-0,72; P <.001). Uno studio di follow-up a lungo termine a 38 mesi ha ulteriormente confermato l’effetto di palbociclib sulla PFS, con un aumento a 27,6 mesi rispetto ai 14,5 mesi del solo letrozolo (HzR, 0,563; 95% CI, 0,461-0,687; P <.0001). Lo studio di follow-up ha anche riportato un miglioramento costante della PFS con palbociclib più letrozolo in tutti i sottogruppi studiati, così come il ritardo del tempo mediano all’inizio della terapia successiva. Tuttavia, i dati di sopravvivenza globale (OS) per i rapporti iniziali e di follow-up erano immaturi, e le pazienti arruolate sono seguite per la sopravvivenza.10,11
Poco dopo l’inizio di PALOMA-2, un altro studio di fase III, PALOMA-3, è stato iniziato per valutare la sicurezza e l’efficacia di palbociclib più fulvestrant in donne in premenopausa o postmenopausa con cancro al seno avanzato HR+ che è progredito su ET precedente. Il rapporto iniziale dopo 5,6 mesi di follow-up ha mostrato un miglioramento della PFS mediana (9,2 mo vs 3,8 mo), con una riduzione del 58% della progressione (HzR, 0,42; 95% CI, 0,32-0,56; P <.001).12 Un’analisi prespecificata della OS nello studio PALOMA-3, utilizzando un follow-up mediano di 44.8 mesi, ha rilevato che le differenze nella OS per l’intero gruppo intention-to-treat non hanno raggiunto la significatività statistica, ma la combinazione ha prolungato la OS di 10 mesi nei pazienti che erano sensibili al precedente ET.14
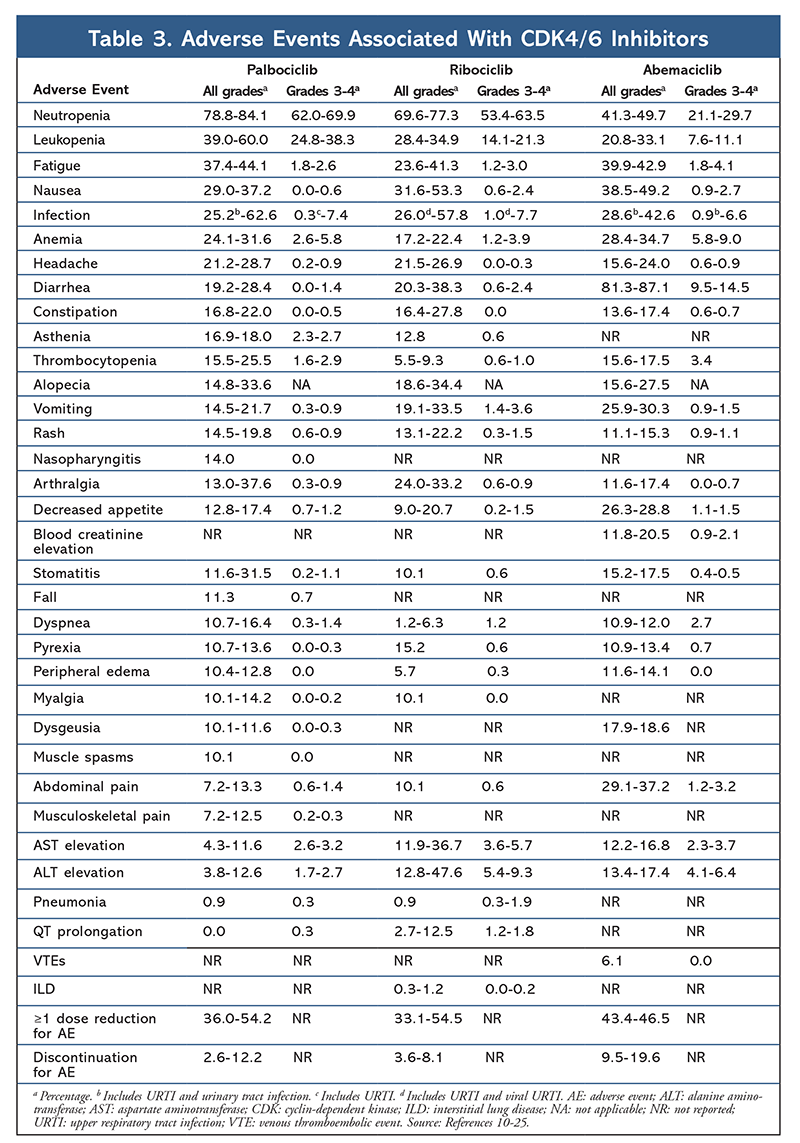
Il profilo degli effetti collaterali è rimasto coerente in tutti gli studi (TABELLA 3), con neutropenia di tutti i gradi (78,8%-84,1%), leucopenia (39%-60%) e affaticamento (37,4%-44,1%) come gli effetti collaterali più frequentemente riportati. I tassi di neutropenia erano alti; tuttavia, la neutropenia febbrile era rara (fino al 2%). La tollerabilità complessiva di palbociclib è stata considerata gestibile, e l’agente ha prodotto dati positivi sulla qualità della vita quando utilizzato nella terapia combinata rispetto alla monoterapia endocrina.9,14
Ribociclib
Un secondo inibitore CDK4/6, ribociclib, è stato approvato dalla FDA nel 2017 con una popolazione di pazienti indicata più ampia. Ribociclib è approvato per le donne in postmenopausa e in pre o perimenopausa con carcinoma mammario HR+, HER2- avanzato o metastatico (come terapia di combinazione con un AI come ET iniziale o, nelle donne in postmenopausa, combinato con fulvestrant come ET iniziale o dopo la progressione della malattia su ET).7
Ribociclib ha ricevuto l’approvazione della FDA dopo che lo studio MONALEESA-2 ha rilevato che la PFS era migliore quando il farmaco veniva dato in combinazione con letrozolo rispetto al solo letrozolo. I tassi di PFS valutati localmente rispetto al solo letrozolo dopo 18 mesi erano rispettivamente del 63,0% (95% CI, 54,6-70,3) e del 42,2% (95% CI, 34,8-49,5).15 Un rapporto di follow-up esteso a 26,4 mesi ha ulteriormente dimostrato l’efficacia e la tollerabilità della combinazione.16 Nonostante il miglioramento della PFS, i dati OS per MONALEESA-2 rimangono immaturi.
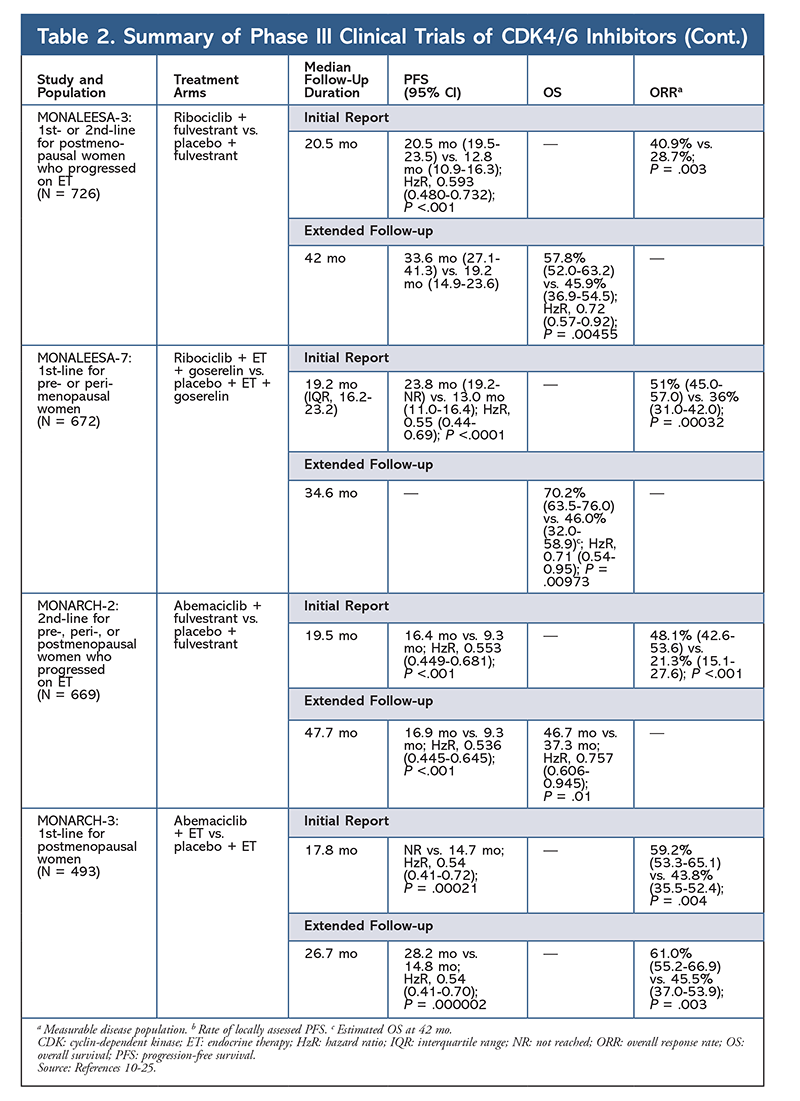
Ribociclib è stato anche studiato (in MONALEESA-3) in combinazione con fulvestrant in pazienti naïve al trattamento e in quelle che sono ricadute dopo ET. Il rapporto iniziale ha rivelato un miglioramento della PFS per la combinazione rispetto al solo fulvestrant (20,5 mo vs. 12,8 mo, rispettivamente; HzR, 0,593; 95% CI, 0,480-0,732; P <.001), che ha portato all’approvazione FDA di questa combinazione.17 Un secondo, e più recente, rapporto sull’inibitore CDK4/6, con 21,6 mesi aggiuntivi di follow-up, ha ulteriormente dimostrato il consistente miglioramento della PFS. Questo rapporto ha anche dimostrato il beneficio OS di ribociclib più fulvestrant rispetto al solo fulvestrant, con una stima di OS a 42 mesi del 57,8% contro il 45,9%, rispettivamente, e una riduzione del 28% del rischio relativo di morte (HzR, 0,72; 95% CI, 0,57-0.92; P = .00455).18
Un terzo studio clinico, MONALEESA-7, è attualmente l’unico studio di fase III per valutare l’efficacia e la sicurezza di un inibitore di CDK4/6 come terapia di prima linea per donne in pre- o perimenopausa che hanno un cancro al seno metastatico. In questo studio, ribociclib più tamoxifene o un AI non steroideo (NSAI) – come letrozolo o anastrozolo – più goserelin ha migliorato significativamente la PFS di 23,8 mesi rispetto ai 13 mesi del gruppo placebo (HzR, 0,55; 95% CI, 0,44-0,69; P <.0001), e la combinazione ha portato all’indicazione estesa che include donne in pre e perimenopausa.19 Un rapporto di follow-up esteso ha dimostrato il beneficio in termini di OS della combinazione ribociclib più tamoxifene o un NSAI più goserelin rispetto al placebo, con una stima di OS a 42 mesi del 70,2% contro il 46,0%.20
Il profilo di tossicità di ribociclib è molto simile a quello di palbociclib, con neutropenia e leucopenia che sono i più alti AE di tutti i gradi e gravi (gradi 3/4) riportati, sebbene a tassi inferiori rispetto al palbociclib (TABELLA 3).15-20 La neutropenia febbrile è stata rara, e non sono emersi nuovi problemi di sicurezza con un’esposizione più lunga a ribociclib in nessuno dei rapporti di follow-up esteso.
Abemaciclib
Il terzo inibitore CDK4/6 ad essere approvato dalla FDA è abemaciclib. Questo agente è indicato in combinazione con un AI come ET iniziale in donne in postmenopausa con cancro al seno avanzato, o in combinazione con fulvestrant in donne in pre-, peri-, o postmenopausa con progressione della malattia dopo ET. Abemaciclib è approvato anche come monoterapia in uomini e donne con progressione della malattia dopo ET e precedente chemioterapia in ambito metastatico.6 L’agente ha inizialmente ottenuto l’approvazione sulla base dei risultati di MONARCH-1 che dimostrano una promettente attività clinica dopo 12 mesi, con un tasso di risposta globale (ORR) del 19,7% (95% CI, 13,3-27,5) e una PFS mediana di 6 mesi.5,21 Durante questo periodo, abemaciclib è stato anche studiato in MONARCH-2 per donne in pre-, peri-, e postmenopausa che progredivano con ET. Questo studio ha dimostrato un beneficio statisticamente significativo della PFS con una combinazione di abemaciclib più fulvestrant rispetto al solo fulvestrant (16,4 mo vs 9,3 mo; HzR, 0,553; 95% CI, 0,449-0,681; P <.001).22 Uno studio di follow-up esteso con una durata mediana di 47.7 mesi ha riportato risultati PFS leggermente migliori e un beneficio OS con la combinazione abemaciclib rispetto al placebo rispetto al fulvestrant (46,7 mo vs. 37,3 mo; 95% CI, 0,606-0,945; P = .01).23
Poco dopo l’inizio dei due studi abemaciclib, è stato avviato MONARCH-3. Questo studio ha trovato un miglioramento statisticamente significativo in PFS e ORR con abemaciclib più un NSAI rispetto al braccio placebo-plus-NSAI come trattamento di prima linea per le donne in postmenopausa. Un rapporto aggiornato con 8,9 mesi di follow-up aggiuntivo ha ulteriormente confermato i risultati PFS e ORR dell’analisi iniziale; tuttavia, i dati OS rimangono immaturi, e l’analisi OS finale sarà condotta dopo 315 eventi.24,25
In generale, abemaciclib è stato notato per essere l’inibitore CDK4/6 più potente, con un’eccellente attività del sistema nervoso centrale grazie alla sua struttura, che gli permette di attraversare la barriera emato-encefalica e rimanere sul bersaglio più a lungo.5 Questo può essere vantaggioso per i pazienti con metastasi al cervello. Sebbene abemaciclib abbia anche alte percentuali di AE ematologici, queste percentuali sono molto più basse di quelle di altri inibitori CDK4/6. Abemaciclib è associato a più tossicità gastrointestinali, come la diarrea, rispetto ad altri inibitori CDK4/6 (tutti i gradi: 81,3%-87,1%; gradi 3-4: 9,5%-14,5%).22-25
Il ruolo del farmacista
In generale, i profili AE dei vari inibitori CDK 4/6 sono simili, ma ogni farmaco ha AE unici. Gli effetti collaterali più comuni riportati con gli inibitori CDK4/6 sono neutropenia, leucopenia, affaticamento, nausea, infezioni, artralgia, anemia, mal di testa e diarrea (TABELLA 3). A parte la neutropenia e la leucopenia, la maggior parte dei pazienti ha riportato AE di grado 1 o 2. La neutropenia e la leucopenia di grado 3 o 4, che erano molto comuni con tutti gli inibitori CDK, in particolare con palbociclib e ribociclib, sono state gestite principalmente con l’interruzione e/o la riduzione della dose. L’emocromo del paziente deve essere monitorato al basale, ogni 2 settimane per i primi due cicli, all’inizio di ogni quattro cicli successivi, e come clinicamente necessario per la soppressione del midollo osseo.6-8 Cadute, spasmi muscolari e nasofaringite sono associati a palbociclib, ma sono lievi nella maggior parte dei casi.10,11,14 Una bassa incidenza di prolungamento del QT è stata riportata con ribociclib.15-20 Abemaciclib è stato associato a un’incidenza significativamente maggiore di diarrea rispetto a palbociclib e ribociclib; i casi si sono verificati soprattutto durante il primo ciclo e potrebbero essere gestiti con una terapia antidiarroica.22-25 Abemaciclib è stato associato a innalzamento della creatinina sierica ed eventi tromboembolici venosi (per lo più lievi), che non sono stati riportati per palbociclib e ribociclib, e una maggiore incidenza di dolore addominale.22-25 In particolare, nel settembre 2019, la FDA ha avvertito che nei pazienti trattati con inibitori di CDK4/6 possono verificarsi malattie polmonari interstiziali (ILD) e polmoniti rare ma gravi, pericolose per la vita o mortali.26 Pertanto, i pazienti devono essere monitorati regolarmente per sintomi polmonari indicativi di ILD e/o polmonite.
Conclusione
Le approvazioni di palbociclib, ribociclib e abemaciclib negli ultimi anni hanno ampliato le opzioni di trattamento per i pazienti con cancro al seno avanzato. Anche se tutti possiedono lo stesso meccanismo d’azione, questi farmaci hanno lievi differenze di efficacia e sicurezza. Un certo numero di studi in corso oltre a quelli menzionati in questa recensione continuano ad esplorare questi inibitori in diverse popolazioni di pazienti e con diverse combinazioni di trattamento. Il potenziale di questi agenti per espandere l’uso degli inibitori CDK4/6 in contesti diversi dal carcinoma mammario avanzato HR+ e HER2 sembra promettente.27
1. Siegel RL, Miller KD, Jemal A. Statistiche sul cancro, 2020. CA Cancer J Clin. 2020;70(1):7-30.
2. Preusser M, De Mattos-Arruda L, Thill M, et al. CDK4/6 inhibitors in the treatment of patients with breast cancer: summary of a multidisciplinary round-table discussion. ESMO Open. 2018;3(5):e000368.
3. Tripathy D, Bardia A, Sellers WR. Ribociclib (LEE011): meccanismo d’azione e impatto clinico di questo inibitore selettivo della chinasi 4/6 ciclina-dipendente in vari tumori solidi. Clin Cancer Res. 2017;23(13):3251-3262.
4. Portman N, Alexandrou S, Carson E, et al. Overcoming CDK4/6 inhibitor resistance in ER-positive breast cancer. Endocr Relat Cancer. 2019;26(1):R15-R30.
5. Sobhani N, D’Angelo A, Pittacolo M, et al. Aggiornamenti sulla strategia inibitoria di CDK4/6 e sulle combinazioni nel cancro al seno. Cells. 2019;8(4):E321.
6. Ibrance (palbociclib) package insert. New York, NY: Pfizer Inc; settembre 2019.
7. Kisqali (ribociclib) foglietto illustrativo. East Hanover, NJ: Novartis Pharmaceuticals Corp; settembre 2019.
8. Verzenio (abemaciclib) foglio illustrativo. Indianapolis, IN: Eli Lilly and Co; settembre 2019.
9. Finn RS, Crown JP, Lang I, et al. The cyclin-dependent kinase 4/6 inhibitor palbociclib in combination with letrozole versus letrozole alone as first-line treatment of oestrogen receptor-positive, HER2-negative, advanced breast cancer (PALOMA-1/TRIO-18): a randomised phase 2 study. Lancet Oncol. 2015;16(1):25-35.
10. Finn RS, Martin M, Rugo HS, et al. Palbociclib e letrozolo nel cancro al seno avanzato. N Engl J Med. 2016;375(20):1925-1936.
11. Rugo HS, Finn RS, Diéras V, et al. Palbociclib più letrozolo come terapia di prima linea nel carcinoma mammario avanzato positivo al recettore degli estrogeni/negativo al recettore del fattore di crescita epidermico umano 2 con follow-up esteso. Breast Cancer Res Treat. 2019;174(3):719-729.
12. Turner NC, Ro J, André F, et al. Palbociclib nel cancro al seno avanzato positivo al recettore ormonale. N Engl J Med. 2015;373(3):209-219.
13. Cristofanilli M, Turner NC, Bondarenko I, et al. Fulvestrant più palbociclib contro fulvestrant più placebo per il trattamento del carcinoma mammario metastatico ormono-recettore-positivo, HER2-negativo che è progredito sulla precedente terapia endocrina (PALOMA-3): analisi finale del multicentrico, doppio cieco, fase 3 studio randomizzato controllato. Lancet Oncol. 2016;17(4):425-439.
14. Turner NC, Slamon DJ, Ro J, et al. Sopravvivenza globale con palbociclib e fulvestrant nel cancro al seno avanzato. N Engl J Med. 2018;379(20):1926-1936.
15. Hortobagyi GN, Stemmer SM, Burris HA, et al. Ribociclib come terapia di prima linea per il cancro al seno avanzato HR-positivo. N Engl J Med. 2016;375(18):1738-1748.
16. Hortobagyi GN, Stemmer SM, Burris HA, et al. Risultati aggiornati da MONALEESA-2, uno studio di fase III di ribociclib di prima linea più letrozolo contro placebo più letrozolo nel cancro al seno avanzato positivo al recettore ormonale, HER2-negativo. Ann Oncol. 2018;29(7):1541-1547.
17. Slamon DJ, Neven P, Chia S, et al. Studio randomizzato di fase III di ribociclib e fulvestrant nel carcinoma mammario avanzato positivo al recettore ormonale, recettore del fattore di crescita epidermico umano 2-negativo: MONALEESA-3. J Clin Oncol. 2018;36(24):2465-2472.
18. Slamon DJ, Neven P, Chia S, et al. Sopravvivenza globale con ribociclib più fulvestrant nel cancro al seno avanzato. N Engl J Med. 2020;382(6):514-524.
19. Tripathy D, Im SA, Colleoni M, et al. Ribociclib più terapia endocrina per le donne in premenopausa con recettore ormonale-positivo, cancro al seno avanzato (MONALEESA-7): uno studio randomizzato, fase 3. Lancet Oncol. 2018;19(7):904-915.
20. Im SA, Lu YS, Bardia A, et al. Sopravvivenza globale con ribociclib più terapia endocrina nel cancro al seno. N Engl J Med. 2019;381(4):307-316.
21. Dickler MN, Tolaney SM, Rugo HS, et al. MONARCH 1, uno studio di fase II di abemaciclib, un inibitore di CDK4 e CDK6, come agente singolo, in pazienti con cancro al seno metastatico HR+/HER2- refrattario. Clin Cancer Res. 2017;23(17):5218-5224.
22. Sledge GW Jr, Toi M, Neven P, et al. MONARCH 2: abemaciclib in combinazione con fulvestrant in donne con carcinoma mammario avanzato HR+/HER2- che erano progredite mentre ricevevano la terapia endocrina. J Clin Oncol. 2017;35(25):2875-2884.
23. Sledge GW Jr, Toi M, Neven P, et al. L’effetto di abemaciclib più fulvestrant sulla sopravvivenza complessiva nel cancro al seno positivo al recettore ormonale, ERBB2-negativo che è progredito sulla terapia endocrina-MONARCH 2: uno studio clinico randomizzato. JAMA Oncol. 2020;6(1):116-124.
24. Goetz MP, Toi M, Campone M, et al. MONARCH 3: abemaciclib come terapia iniziale per il cancro al seno avanzato. J Clin Oncol. 2017;35(32):3638-3646.
25. Johnston S, Martin M, Di Leo A, et al. MONARCH 3 finale PFS: uno studio randomizzato di abemaciclib come terapia iniziale per il cancro al seno avanzato. NPJ Breast Cancer. 2019;17(5):5.
26. FDA. FDA avverte circa la rara ma grave infiammazione polmonare con Ibrance, Kisqali e Verzenio per il cancro al seno. www.fda.gov/drugs/drug-safety-and-availability/fda-warns-about-rare-severe-lung-inflammation-ibrance-kisqali-and-verzenio-breast-cancer. Accesso al 15 gennaio 2020.
27. Shah M, Nunes MR, Stearns V. Inibitori CDK4/6: cambiano i giochi nella gestione del cancro al seno avanzato positivo al recettore ormonale? Oncologia (Williston Park). 2018;32(5):216-222.
Il contenuto di questo articolo è solo a scopo informativo. Il contenuto non vuole essere un sostituto della consulenza professionale. L’affidamento su qualsiasi informazione fornita in questo articolo è esclusivamente a proprio rischio e pericolo.
