Dipoolmomenten
De asymmetrische ladingsverdeling in een polaire stof zoals HCl levert een dipoolmoment op waarbij \( Qr \) in meter (m). wordt afgekort met de Griekse letter mu (µ). Het dipoolmoment is gedefinieerd als het product van de partiële lading Q op de gebonden atomen en de afstand r tussen de partiële ladingen.
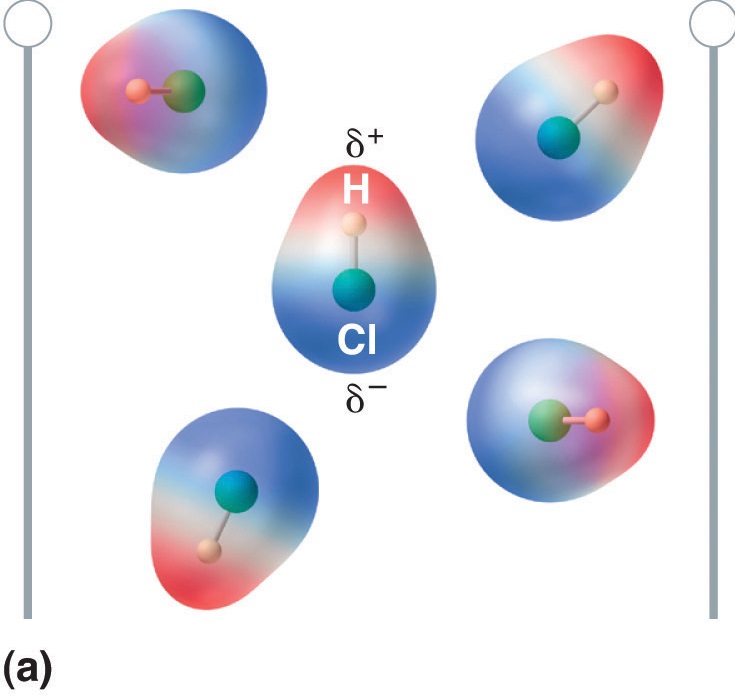
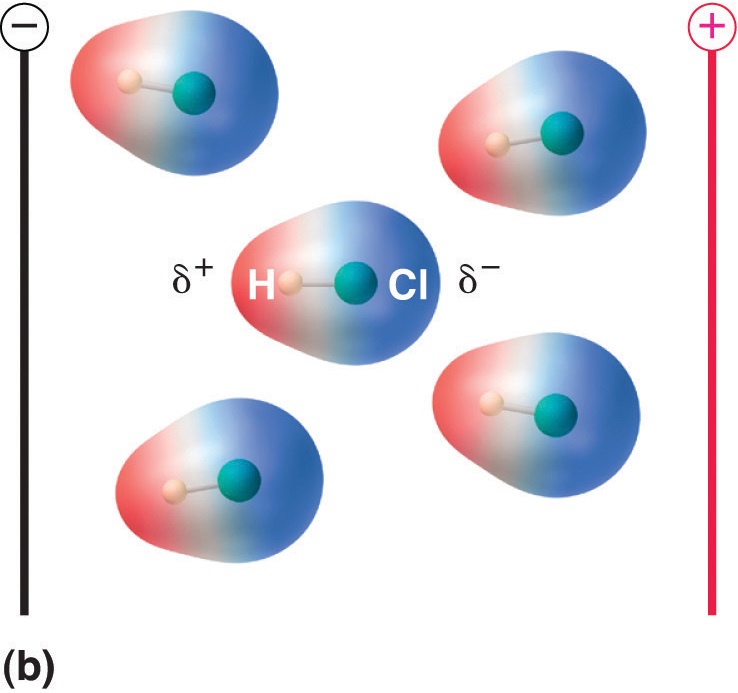
Wanneer een molecuul met een dipoolmoment in een elektrisch veld wordt geplaatst, heeft het door zijn asymmetrische ladingsverdeling de neiging zich met het elektrische veld mee te oriënteren (figuur
Figuur
(\PageIndex{5})): Moleculen met een dipoolmoment richten zich gedeeltelijk uit bij een elektrisch veld. In afwezigheid van een veld (a), zijn de HCl moleculen willekeurig georiënteerd. Wanneer een elektrisch veld wordt aangelegd (b), hebben de moleculen de neiging zich uit te lijnen met het veld, zodanig dat het positieve uiteinde van de moleculaire dipool naar het negatieve uiteinde wijst en omgekeerd.
Het gemeten dipoolmoment van HCl geeft aan dat de H-Cl binding ongeveer 18% ionisch karakter heeft (0,1811 × 100), of 82% covalent karakter. In plaats van HCl te schrijven als
kunnen we de ladingsscheiding dus kwantitatief aangeven als
Onze berekende resultaten zijn in overeenstemming met het elektronegativiteitsverschil tussen waterstof en chloor χH = 2.20; χCl = 3.16, χCl – χH = 0.96), een waarde die ruim binnen het bereik voor polaire covalente bindingen ligt. We geven het dipoolmoment aan door een pijl boven het molecuul te schrijven. Wiskundig gezien zijn dipoolmomenten vectoren, en ze hebben zowel een magnitude als een richting. Het dipoolmoment van een molecuul is de vectorsom van de dipolen van de afzonderlijke bindingen. In HCl bijvoorbeeld wordt het dipoolmoment als volgt aangegeven:
![]()
De pijl geeft de richting van de elektronenstroom aan door naar het meer elektronegatieve atoom te wijzen.
De lading op de atomen van veel stoffen in de gasfase kan worden berekend met behulp van gemeten dipoolmomenten en bindingsafstanden. Figuur toont een grafiek van het percentage ionisch karakter versus het verschil in elektronegativiteit van de gebonden atomen voor verschillende stoffen. Volgens de grafiek is de binding in soorten als NaCl(g) en CsF(g) substantieel minder dan 100% ionisch van karakter. Wanneer het gas echter condenseert tot een vaste stof, vergroten dipool-dipool interacties tussen gepolariseerde soorten de ladingsscheidingen. In het kristal wordt daarom een elektron overgedragen van het metaal naar het niet-metaal, en deze stoffen gedragen zich als klassieke ionische verbindingen. De gegevens in figuur laten zien dat diatomeeënsoorten met een elektronegativiteitsverschil van minder dan 1,5 voor minder dan 50% ionisch van karakter zijn, hetgeen overeenkomt met onze eerdere beschrijving van deze soorten als soorten die polaire covalente bindingen bevatten. Het gebruik van dipoolmomenten om het ionische karakter van een polaire binding te bepalen wordt geïllustreerd in Voorbeeld (Pagina-index{2}).
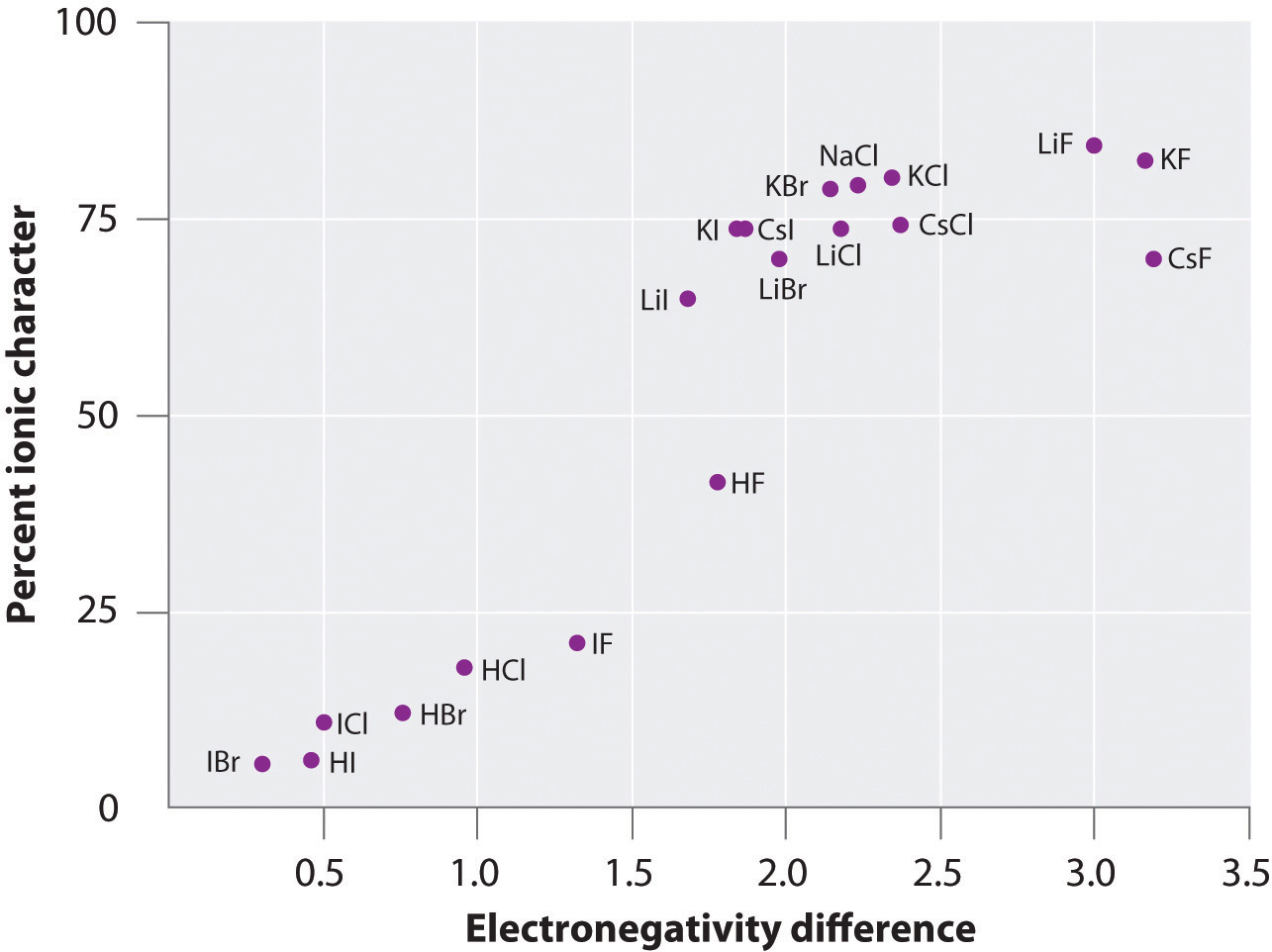
Figuur (Pagina-index{6}): Een diagram van het procentuele ionische karakter van een binding, zoals bepaald uit de gemeten dipoolmomenten, afgezet tegen het verschil in elektronegativiteit van de gebonden atomen. In de gasfase is zelfs CsF, dat het grootst mogelijke verschil in elektronegativiteit tussen de atomen heeft, niet 100% ionisch. Vast CsF kan echter het best als 100% ionisch worden beschouwd vanwege de extra elektrostatische interacties in het rooster.
