Enthalpie
Thermodynamica is de studie van de relatie tussen warmte (of energie) en arbeid. Enthalpie is een centrale factor in de thermodynamica. Het is de warmte-inhoud van een systeem. De warmte die tijdens een reactie in of uit het systeem gaat, is de enthalpieverandering. Of de enthalpie van het systeem toeneemt (d.w.z. wanneer energie wordt toegevoegd) of afneemt (omdat energie wordt afgegeven) is een cruciale factor die bepaalt of een reactie kan plaatsvinden.
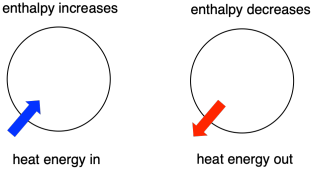
Soms noemen we de energie van de moleculen die een verandering ondergaan de “interne enthalpie”. Soms noemen we het de “enthalpie van het systeem”. Deze twee uitdrukkingen verwijzen naar hetzelfde. Op dezelfde manier wordt de energie van de moleculen die niet deelnemen aan de reactie de “externe enthalpie” of de “enthalpie van de omgeving” genoemd.
Ruwweg waren de energieveranderingen die we in de inleiding tot de thermodynamica hebben bekeken, veranderingen in enthalpie. We zullen in het volgende hoofdstuk zien dat er nog een andere energetische factor is, entropie, waarmee we ook rekening moeten houden bij reacties. Voorlopig kijken we alleen naar enthalpie.
- Enthalpie is de warmte-inhoud van een systeem.
- De enthalpieverandering van een reactie komt ruwweg overeen met de hoeveelheid energie die tijdens de reactie verloren gaat of gewonnen wordt.
- Een reactie is gunstig als de enthalpie van het systeem tijdens de reactie afneemt.
Die laatste uitspraak lijkt veel op de beschrijving van de energetica op de vorige bladzijde. Als een systeem een reactie ondergaat en energie afgeeft, neemt zijn eigen energie-inhoud af. Het heeft minder energie over als het wat weggaf. Waarom verandert de energie van een stel moleculen als er een reactie optreedt? Om dat te beantwoorden, moeten we nadenken over wat er in een chemische reactie gebeurt.
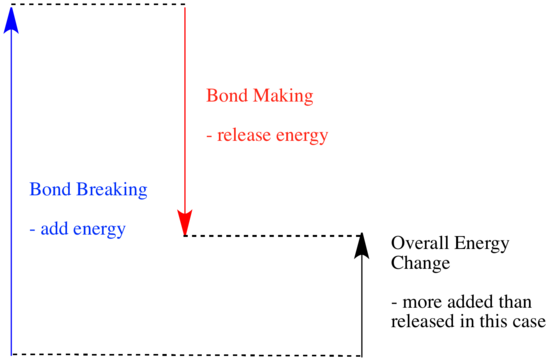
In een reactie is er een verandering in de chemische binding. Sommige bindingen in de reactanten worden verbroken, en nieuwe bindingen worden gemaakt om de producten te vormen. Het kost energie om bindingen te verbreken, maar er komt energie vrij als er nieuwe bindingen worden gemaakt.
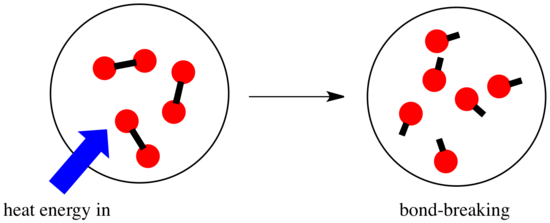
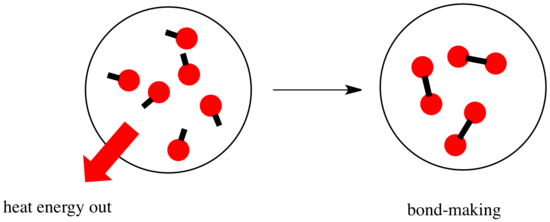
Of een reactie door kan gaan, kan afhangen van het evenwicht tussen deze bindingsmakende en bindingsafbrekende stappen.
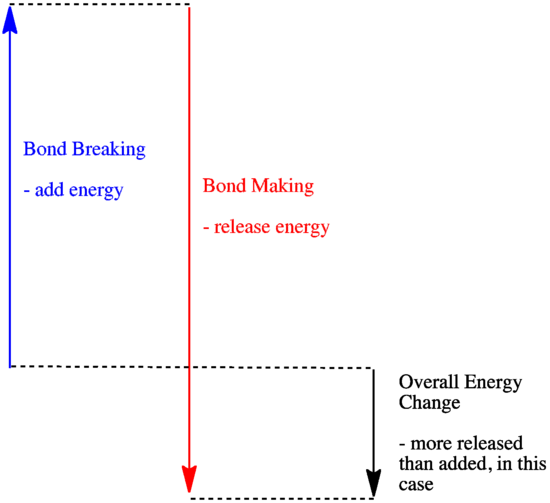
- Een reactie is exotherm als er meer energie vrijkomt bij de vorming van nieuwe bindingen dan er wordt verbruikt bij het verbreken van oude bindingen.
- Een reactie is exotherm als zwakkere bindingen worden ingeruild voor sterkere.
- Een reactie is endotherm als het verbreken van bindingen meer energie kost dan wat wordt geleverd bij het maken van bindingen.
Bindingsenergieën (de hoeveelheid energie die moet worden toegevoegd om een binding te verbreken) zijn een belangrijke factor bij het bepalen of een reactie zal optreden. Bindingssterkten zijn niet altijd gemakkelijk te voorspellen, omdat de sterkte van een binding afhangt van een aantal factoren. Veel mensen hebben echter veel werk verricht om de sterkte van bindingen te meten, en zij hebben de informatie in tabellen verzameld, dus als je wilt weten hoe sterk een binding is, kun je de informatie die je nodig hebt gewoon opzoeken.
| Bond | Bondenergie (kcal/mol) | Bond | Bondenergie (kcal/mol) |
| H-H | 104 | O-H | 111 |
| C-C | 83 | C-H | 99 |
| O=O | 119 | N-H | 93 |
| N=N | 226 | C=O | 180 |
Voorbeeld, stel dat u wilt weten of de verbranding van methaan een exotherme of endotherme reactie is. Ik ga ervan uit dat het exotherm is, omdat deze reactie (en andere zoals deze) wordt gebruikt om veel huizen van warmte te voorzien door aardgas in ovens te verbranden.
De “verbranding” van methaan betekent dat het in lucht wordt verbrand, zodat het reageert met zuurstof. De producten van de verbranding van koolwaterstoffen zijn voornamelijk kooldioxide en water. Het koolstofatoom in methaan (CH4) wordt opgenomen in een kooldioxidemolecuul. De waterstofatomen worden opgenomen in watermoleculen. Er zitten vier waterstofatomen in methaan, dus dat is genoeg om twee moleculen H2O te maken.
- Vier C-H bindingen moeten worden verbroken bij de verbranding van methaan.
- Vier nieuwe O-H bindingen worden gemaakt als de waterstofatomen uit methaan worden toegevoegd aan nieuwe watermoleculen.
- Twee nieuwe C=O bindingen worden gemaakt wanneer de koolstof uit methaan wordt toegevoegd aan een CO2 molecuul.
Het andere stukje van de puzzel is de zuurstofbron voor de reactie. Zuurstof is in de atmosfeer vooral aanwezig als O2. Omdat we twee zuurstofatomen nodig hebben in het CO2-molecuul en nog eens twee zuurstofatomen voor de twee watermoleculen, hebben we in totaal vier zuurstofatomen nodig voor de reactie, die geleverd kunnen worden door twee O2-moleculen.
-
Twee O=O bindingen moeten worden verbroken om de zuurstofatomen voor de producten te leveren.
Totaal zijn dat vier C-H en twee O=O bindingen die worden verbroken, plus twee C=O en vier O-H bindingen die worden gemaakt. Dat is 4 x 99 kcal/mol voor de C-H bindingen en 2 x 119 kcal/mol voor de O=O bindingen, een totaal van 634 kJ/mol toegevoegd. Bij de reactie komt 2 x 180 kcal/mol vrij voor de C=O bindingen en 4 x 111 kcla/mol voor de OH bindingen, in totaal 804 kcal/mol. In totaal komt er dus 170 kcal/mol meer vrij dan er verbruikt wordt.
Dat betekent dat de reactie exotherm is, dus warmte produceert. Het is waarschijnlijk een goede manier om je huis te verwarmen.
