US Pharm. 2020;45(5)(Specialty&Oncology suppl):3-8.
ABSTRACT: In de afgelopen jaren zijn verschillende nieuwe gerichte therapieopties ontwikkeld om resistentie tegen traditionele endocriene therapie voor gevorderde borstkanker te bestrijden. Drie CDK4/6 remmers (palbociclib, ribociclib en abemaciclib) zijn goedgekeurd voor patiënten met hormoonreceptor-positieve, humane epidermale groeifactorreceptor 2-negatieve borstkanker in een gevorderd stadium. Elk middel heeft zijn werkzaamheid aangetoond, maar er bestaan verschillen tussen de drie geneesmiddelen, met name in hun bijwerkingen.
Borstkanker is de meest voorkomende vorm van kanker bij vrouwen, met naar schatting meer dan 276.000 nieuwe gevallen in 2020.1 Hormoonreceptor-positieve (HR+) borstkanker, die meer dan 70% van deze gevallen uitmaakt, wordt van oudsher behandeld met endocriene therapie (ET), zoals selectieve oestrogeenreceptorremmers en aromataseremmers (AI’s). Hoewel ET de ruggengraat blijft van de behandeling van HR+ borstkanker, ontwikkelt zich resistentie bij tot 50% van de patiënten met gevorderde borstkanker.2 Om resistentie te bestrijden, zijn gerichte therapieën goedgekeurd voor HR+ borstkanker.3,4
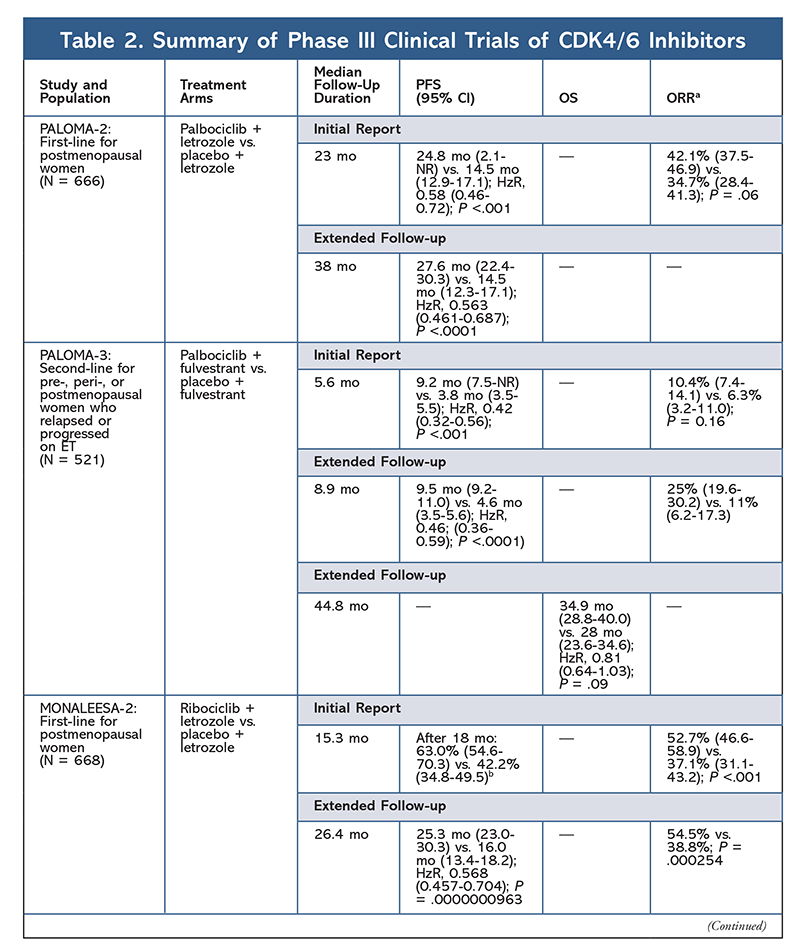
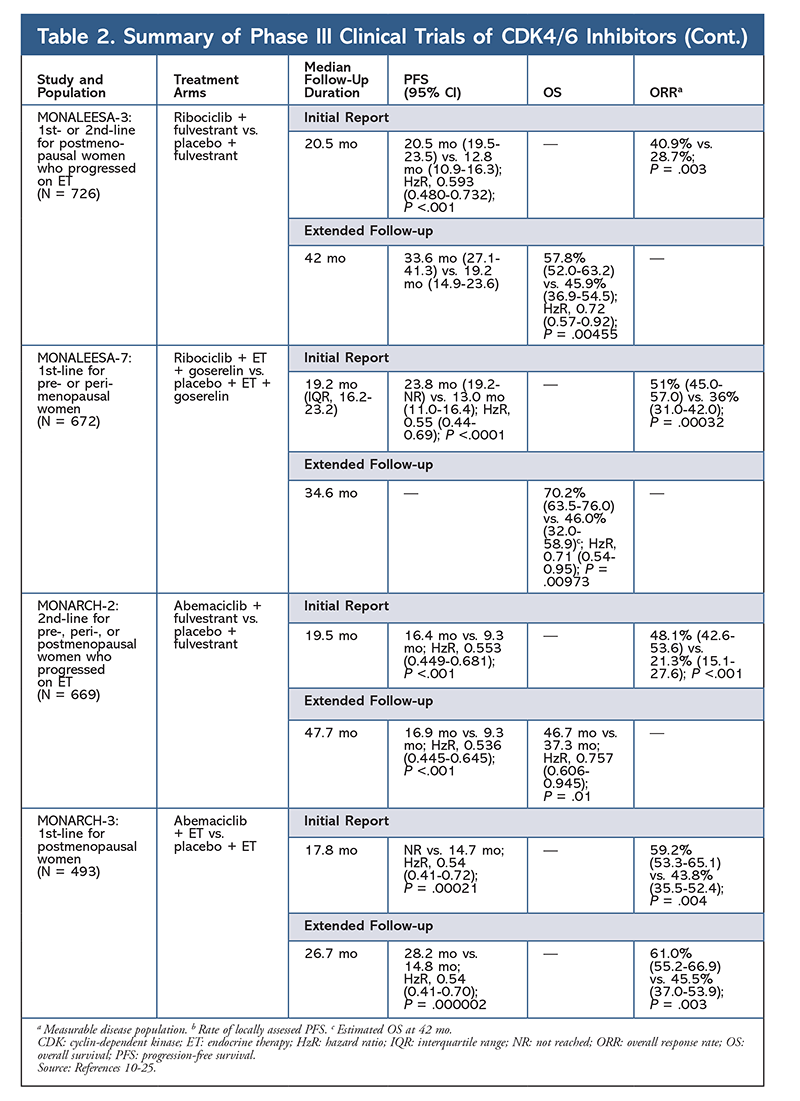
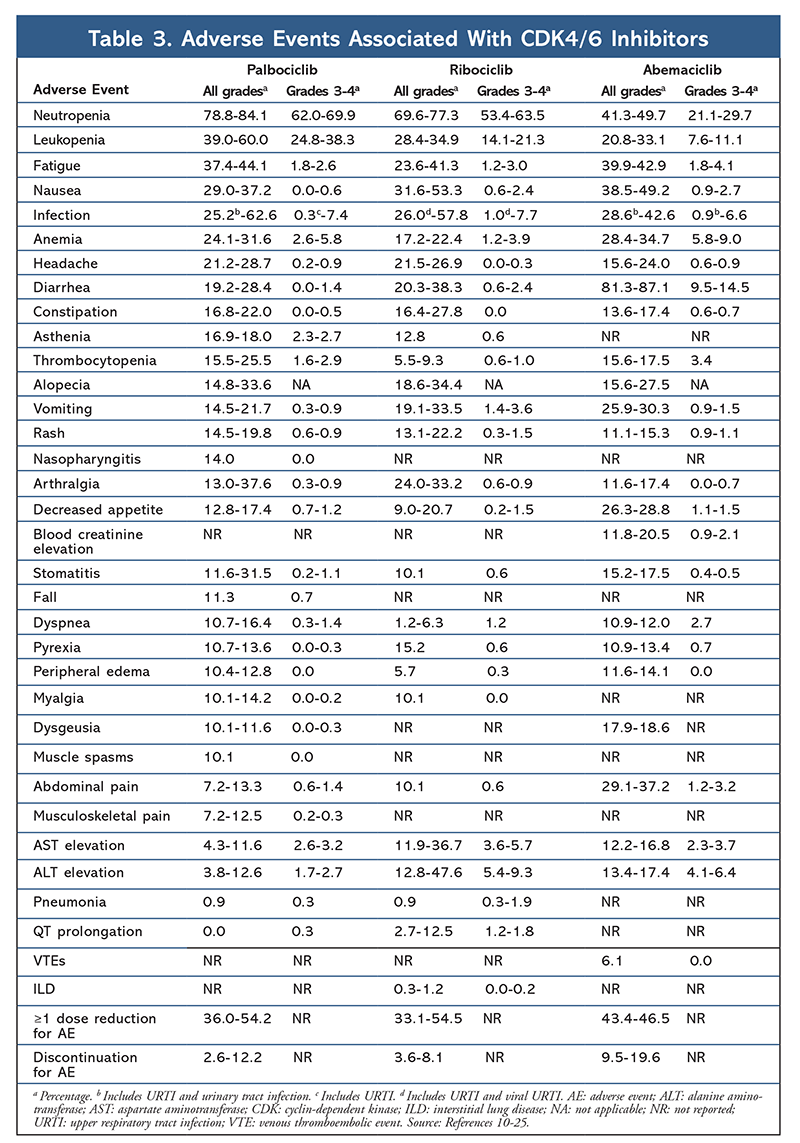
Cycline-afhankelijke kinase (CDK) remmers, de nieuwste klasse van belang voor gevorderde borstkanker, werken door specifiek CDK4/6 eiwitten te remmen en de overgang van de G1 naar de S-fase van de celcyclus te blokkeren. Deze klasse geneesmiddelen remt de kinaseactiviteit, die de retinoblastoma-eiwitroute fosforyleert. Door dit pad te blokkeren, zijn CDK4/6-remmers in staat de voortgang van de celcyclus in het midden van de G1-fase te blokkeren en kankercelprogressie te voorkomen. De afgelopen jaren zijn drie CDK4/6-remmers (palbociclib, ribociclib en abemaciclib) goedgekeurd als combinatietherapie voor HR+, humane epidermale groeifactor receptor 2-negatieve (HER2-), vergevorderde of uitgezaaide borstkankers.5-8 In dit artikel worden de verschillen tussen deze middelen (TABEL 1), klinische proeven van fase III (TABEL 2) en bijwerkingenprofielen (TABEL 3) besproken.
Palbociclib
In 2015 werd palbociclib de eerste CDK4/6-remmer die FDA-goedkeuring kreeg voor de behandeling van HR+, HER2- borstkanker (in combinatie met een AI als initiële ET bij postmenopauzale vrouwen of bij mannen, of in combinatie met fulvestrant bij patiënten met ziekteprogressie na ET).6,9-14 Palbociclib kreeg aanvankelijk goedkeuring na positieve resultaten van de fase II-studie PALOMA-1, waarin palbociclib plus letrozol werd vergeleken met letrozol alleen als initiële therapie voor ET-naïeve gevorderde borstkankerpatiënten.9
Deze resultaten leidden tot twee fase III-studies waarin het effect van palbociclib in deze patiëntenpopulatie verder werd geëvalueerd. De eerste resultaten van PALOMA-2 bevestigden de effecten van palbociclib plus letrozol, waarbij een verbeterde progressievrije overleving (PFS) werd aangetoond in vergelijking met letrozol alleen (24,8 mo versus 14,5 mo, respectievelijk; hazard ratio voor ziekteprogressie of overlijden, 0,58; 95% CI, 0,46-0,72; P <.001). Een langetermijnfollow-upstudie na 38 maanden bevestigde verder het effect van palbociclib op de PFS, met een toename tot 27,6 maanden versus 14,5 maanden voor letrozol alleen (hazard ratio, 0,563; 95% CI, 0,461-0,687; P <,0001). De vervolgstudie meldde ook een consistente verbetering van de PFS met palbociclib plus letrozol in alle bestudeerde subgroepen, evenals een vertraagde mediane tijd tot het begin van een volgende therapie. Algehele overleving (OS) gegevens voor de initiële en follow-uprapporten waren echter onvolwassen, en ingeschreven patiënten worden gevolgd voor overleving.10,11
Kort na de start van PALOMA-2 werd een andere fase III-studie, PALOMA-3, gestart om de veiligheid en werkzaamheid van palbociclib plus fulvestrant te beoordelen bij premenopauzale of postmenopauzale vrouwen met HR+ gevorderde borstkanker die progressie vertoonde op eerdere ET. Het eerste rapport na 5,6 maanden follow-up toonde een verbetering van de mediane PFS (9,2 mo vs. 3,8 mo), met een 58% vermindering van progressie (HzR, 0,42; 95% CI, 0,32-0,56; P <.001).12 Een voorgespecificeerde analyse van OS in de PALOMA-3-studie, met een mediane follow-up van 44.8 maanden, bleek dat de verschillen in OS voor de gehele intent-to-treat groep geen statistische significantie bereikten, maar dat de combinatie de OS met 10 maanden verlengde bij patiënten die gevoelig waren voor eerdere ET.14
Het AE-profiel bleef consistent in alle onderzoeksrapporten (TABEL 3), met neutropenie van alle graden (78,8%-84,1%), leukopenie (39%-60%), en vermoeidheid (37,4%-44,1%) als de meest frequent gemelde AE’s. De percentages neutropenie waren hoog; febriele neutropenie was echter zeldzaam (tot 2%). De algehele verdraagbaarheid van palbociclib werd als beheersbaar beschouwd, en het middel resulteerde in positieve gegevens over de kwaliteit van leven bij gebruik in combinatietherapie in vergelijking met endocriene monotherapie.9,14
Ribociclib
Een tweede CDK4/6-remmer, ribociclib, werd in 2017 door de FDA goedgekeurd met een bredere geïndiceerde patiëntenpopulatie. Ribociclib is goedgekeurd voor postmenopauzale en pre- of perimenopauzale vrouwen met HR+, HER2- gevorderde of gemetastaseerde borstkanker (als combinatietherapie met een AI als initiële ET of, bij postmenopauzale vrouwen, gecombineerd met fulvestrant als initiële ET of na ziekteprogressie op ET).7
Ribociclib kreeg voor het eerst goedkeuring van de FDA nadat uit de MONALEESA-2-studie bleek dat de PFS verbeterde wanneer het medicijn werd gegeven in combinatie met letrozol versus letrozol alleen. De lokaal beoordeelde PFS ten opzichte van letrozol alleen bedroeg na 18 maanden respectievelijk 63,0% (95% CI, 54,6-70,3) en 42,2% (95% CI, 34,8-49,5).15 Een uitgebreid follow-uprapport na 26,4 maanden toonde de werkzaamheid en verdraagbaarheid van de combinatie verder aan.16 Ondanks de verbetering van de PFS blijven de OS-gegevens voor MONALEESA-2 onvolwassen.
Ribociclib wordt ook onderzocht (in MONALEESA-3) in combinatie met fulvestrant bij behandelings-naïeve patiënten en patiënten die zijn hervallen na ET. Het eerste rapport toonde een betere PFS aan voor de combinatie in vergelijking met fulvestrant alleen (20,5 mo versus 12,8 mo, respectievelijk; HzR, 0,593; 95% CI, 0,480-0,732; P <.001), wat resulteerde in goedkeuring van deze combinatie door de FDA.17 Een tweede, en het meest recente, rapport over CDK4/6-remmers, met 21,6 extra maanden follow-up, toonde de consistente verbetering van de PFS verder aan. Dit rapport bewees ook het OS-voordeel van ribociclib plus fulvestrant in vergelijking met fulvestrant alleen, met een geschatte OS na 42 maanden van respectievelijk 57,8% versus 45,9%, en een vermindering van 28% van het relatieve risico op overlijden (HzR, 0,72; 95% CI, 0,57-0.92; P = .00455).18
Een derde klinische studie, MONALEESA-7, is momenteel de enige fase III-studie ter evaluatie van de werkzaamheid en veiligheid van een CDK4/6-remmer als eerstelijnstherapie voor pre- of perimenopauzale vrouwen die uitgezaaide borstkanker hebben. In deze studie verbeterde ribociclib plus tamoxifen of een niet-steroïde AI (NSAI)-zoals letrozol of anastrozol-plus gosereline de PFS aanzienlijk met 23,8 maanden versus 13 maanden voor de placebogroep (HzR, 0,55; 95% CI, 0,44-0,69; P <,0001), en de combinatie leidde tot de uitgebreide indicatie die pre- en perimenopauzale vrouwen omvat.19 Een uitgebreid follow-uprapport toonde het OS-voordeel aan van de combinatie ribociclib plus tamoxifen of een NSAI plus gosereline in vergelijking met placebo, met een geschatte 42-maands OS van 70,2% versus 46,0%.20
Het toxiciteitsprofiel voor ribociclib lijkt sterk op dat van palbociclib, met neutropenie en leukopenie als de hoogste all-grade en ernstige (gradaties 3/4) AE’s gemeld, hoewel in lagere percentages dan voor palbociclib (TABEL 3).15-20 Koortsneutropenie was zeldzaam, en in geen van de uitgebreide follow-uprapporten ontstonden nieuwe veiligheidsproblemen bij langere blootstelling aan ribociclib.
Abemaciclib
De derde CDK4/6-remmer die door de FDA werd goedgekeurd, is abemaciclib. Dit middel is geïndiceerd in combinatie met een AI als initiële ET bij postmenopauzale vrouwen met gevorderde borstkanker, of in combinatie met fulvestrant bij pre-, peri-, of postmenopauzale vrouwen met ziekteprogressie na ET. Abemaciclib is ook goedgekeurd als monotherapie bij mannen en vrouwen met ziekteprogressie na ET en voorafgaande chemotherapie in de metastatische setting.6 Het middel werd aanvankelijk goedgekeurd op basis van de resultaten van MONARCH-1, waaruit veelbelovende klinische activiteit na 12 maanden bleek, met een overall response rate (ORR) van 19,7% (95% CI, 13,3-27,5) en een mediane PFS van 6 maanden.5,21 In deze periode werd abemaciclib ook onderzocht in MONARCH-2 voor pre-, peri-, en postmenopauzale vrouwen die met ET progressie vertoonden. Deze studie toonde een statistisch significant PFS-voordeel aan met een combinatie van abemaciclib plus fulvestrant versus fulvestrant alleen (16,4 mo vs. 9,3 mo; HzR, 0,553; 95% CI, 0,449-0,681; P <,001).22 Een verlengde follow-upstudie met een mediane duur van 47.7 maanden rapporteerde licht verbeterde PFS-resultaten en OS-voordelen met de abemaciclib-combinatie versus placebo versus fulvestrant (46,7 mo versus 37,3 mo; 95% CI, 0,606-0,945; P = .01).23
Kort na het begin van de twee abemaciclib-onderzoeken werd MONARCH-3 gestart. Deze studie vond een statistisch significante verbetering in PFS en ORR met abemaciclib plus een NSAI in vergelijking met de placebo-plus-NSAI-arm als eerstelijnsbehandeling voor postmenopauzale vrouwen. Een geactualiseerd rapport met 8,9 maanden extra follow-up bevestigde verder de PFS- en ORR-resultaten van de eerste analyse; de OS-gegevens blijven echter onvolwassen, en de definitieve OS-analyse zal worden uitgevoerd na 315 events.24,25
Over het algemeen is vastgesteld dat abemaciclib de meest krachtige CDK4/6-remmer is, met een uitstekende activiteit voor het centrale zenuwstelsel vanwege zijn structuur, waardoor het de bloed-hersenbarrière kan passeren en langer op het doelwit blijft.5 Dit kan gunstig zijn voor patiënten met hersenmetastasen. Hoewel abemaciclib ook hoge percentages hematologische AE’s heeft, zijn deze percentages veel lager dan die voor andere CDK4/6-remmers. Abemaciclib wordt geassocieerd met meer gastro-intestinale toxiciteiten, zoals diarree, dan andere CDK4/6-remmers (alle graden: 81,3%-87,1%; graden 3-4: 9,5%-14,5%).22-25
The Pharmacist’s Role
Over het algemeen zijn de AE-profielen van de verschillende CDK 4/6-remmers vergelijkbaar, maar elk geneesmiddel heeft unieke AE’s. De meest gemelde bijwerkingen van CDK4/6 remmers zijn neutropenie, leukopenie, vermoeidheid, misselijkheid, infectie, gewrichtspijn, anemie, hoofdpijn en diarree (TABEL 3). Afgezien van neutropenie en leukopenie, rapporteerden de meeste patiënten graad 1 of 2 AEs. Graad 3 of 4 neutropenie en leukopenie, die zeer vaak voorkwamen bij alle CDK-remmers, in het bijzonder palbociclib en ribociclib, werden meestal behandeld met dosisonderbreking en/of -vermindering. Het CBC van de patiënt moet worden gecontroleerd bij aanvang, elke 2 weken gedurende de eerste twee cycli, aan het begin van elke volgende vier cycli, en indien klinisch noodzakelijk voor beenmergsuppressie.6-8 Valincidenten, spierspasmen en nasofaryngitis worden geassocieerd met palbociclib, maar zijn in de meeste gevallen mild.10,11,14 Een lage incidentie van QT-verlenging is gemeld met ribociclib.15-20 Abemaciclib werd geassocieerd met een significant hogere incidentie van diarree in vergelijking met palbociclib en ribociclib; gevallen traden meestal op tijdens de eerste cyclus en konden worden behandeld met antidiarree-therapie.22-25 Abemaciclib werd geassocieerd met serumcreatininestijging en veneuze trombo-embolische voorvallen (meestal mild), die niet werden gerapporteerd voor palbociclib en ribociclib, en een hogere incidentie van buikpijn.22-25 Met name in september 2019 waarschuwde de FDA dat zeldzame, maar ernstige, levensbedreigende of fatale interstitiële longaandoeningen (ILD) en pneumonitis kunnen optreden bij patiënten die worden behandeld met CDK4/6-remmers.26 Daarom moeten patiënten regelmatig worden gecontroleerd op pulmonale symptomen die wijzen op ILD en/of pneumonitis.
Conclusie
De goedkeuringen van palbociclib, ribociclib, en abemaciclib in de afgelopen jaren hebben de behandelingsopties voor patiënten met gevorderde borstkanker uitgebreid. Hoewel ze allemaal hetzelfde werkingsmechanisme hebben, vertonen deze geneesmiddelen kleine verschillen in werkzaamheid en veiligheid. Een aantal lopende studies naast die welke in dit overzicht worden genoemd, gaan door met het onderzoeken van deze remmers bij verschillende patiëntenpopulaties en met verschillende behandelingscombinaties. Het potentieel van deze middelen om het gebruik van CDK4/6 remmers uit te breiden naar andere settings dan HR+, HER2- gevorderde borstkanker lijkt veelbelovend.27
1. Siegel RL, Miller KD, Jemal A. Kankerstatistieken, 2020. CA Cancer J Clin. 2020;70(1):7-30.
2. Preusser M, De Mattos-Arruda L, Thill M, et al. CDK4/6 inhibitors in the treatment of patients with breast cancer: summary of a multidisciplinary round-table discussion. ESMO Open. 2018;3(5):e000368.
3. Tripathy D, Bardia A, Sellers WR. Ribociclib (LEE011): werkingsmechanisme en klinische impact van deze selectieve cycline-afhankelijke kinase 4/6 remmer in verschillende solide tumoren. Clin Cancer Res. 2017;23(13):3251-3262.
4. Portman N, Alexandrou S, Carson E, et al. Overcoming CDK4/6 inhibitor resistance in ER-positive breast cancer. Endocr Relat Cancer. 2019;26(1):R15-R30.
5. Sobhani N, D’Angelo A, Pittacolo M, et al. Updates over de CDK4/6-remmingsstrategie en combinaties bij borstkanker. Cells. 2019;8(4):E321.
6. Ibrance (palbociclib) bijsluiter. New York, NY: Pfizer Inc; september 2019.
7. Kisqali (ribociclib) bijsluiter. East Hanover, NJ: Novartis Pharmaceuticals Corp; september 2019.
8. Verzenio (abemaciclib) bijsluiter. Indianapolis, IN: Eli Lilly and Co; september 2019.
9. Finn RS, Crown JP, Lang I, et al. De cycline-afhankelijke kinase 4/6 remmer palbociclib in combinatie met letrozol versus letrozol alleen als eerstelijnsbehandeling van oestrogeenreceptor-positieve, HER2-negatieve, gevorderde borstkanker (PALOMA-1/TRIO-18): een gerandomiseerde fase 2-studie. Lancet Oncol. 2015;16(1):25-35.
10. Finn RS, Martin M, Rugo HS, et al. Palbociclib en letrozol bij gevorderde borstkanker. N Engl J Med. 2016;375(20):1925-1936.
11. Rugo HS, Finn RS, Diéras V, et al. Palbociclib plus letrozol als eerstelijnstherapie bij oestrogeenreceptor-positieve/menselijke epidermale groeifactorreceptor 2-negatieve gevorderde borstkanker met verlengde follow-up. Breast Cancer Res Treat. 2019;174(3):719-729.
12. Turner NC, Ro J, André F, et al. Palbociclib in hormoonreceptor-positieve gevorderde borstkanker. N Engl J Med. 2015;373(3):209-219.
13. Cristofanilli M, Turner NC, Bondarenko I, et al. Fulvestrant plus palbociclib versus fulvestrant plus placebo voor de behandeling van hormoonreceptor-positieve, HER2-negatieve gemetastaseerde borstkanker die gevorderd is op eerdere endocriene therapie (PALOMA-3): eindanalyse van de multicentrische, dubbelblinde, fase 3 gerandomiseerde gecontroleerde trial. Lancet Oncol. 2016;17(4):425-439.
14. Turner NC, Slamon DJ, Ro J, et al. Algehele overleving met palbociclib en fulvestrant bij gevorderde borstkanker. N Engl J Med. 2018;379(20):1926-1936.
15. Hortobagyi GN, Stemmer SM, Burris HA, et al. Ribociclib als eerstelijns therapie voor HR-positieve, gevorderde borstkanker. N Engl J Med. 2016;375(18):1738-1748.
16. Hortobagyi GN, Stemmer SM, Burris HA, et al. Geactualiseerde resultaten van MONALEESA-2, een fase III-studie van eerstelijns ribociclib plus letrozol versus placebo plus letrozol bij hormoonreceptor-positieve, HER2-negatieve, gevorderde borstkanker. Ann Oncol. 2018;29(7):1541-1547.
17. Slamon DJ, Neven P, Chia S, et al. Fase III gerandomiseerde studie van ribociclib en fulvestrant bij hormoonreceptor-positieve, humane epidermale groeifactorreceptor 2-negatieve gevorderde borstkanker: MONALEESA-3. J Clin Oncol. 2018;36(24):2465-2472.
18. Slamon DJ, Neven P, Chia S, et al. Algehele overleving met ribociclib plus fulvestrant bij gevorderde borstkanker. N Engl J Med. 2020;382(6):514-524.
19. Tripathy D, Im SA, Colleoni M, et al. Ribociclib plus endocriene therapie voor premenopauzale vrouwen met hormoonreceptor-positieve, gevorderde borstkanker (MONALEESA-7): een gerandomiseerde, fase 3-studie. Lancet Oncol. 2018;19(7):904-915.
20. Im SA, Lu YS, Bardia A, et al. Algehele overleving met ribociclib plus endocriene therapie bij borstkanker. N Engl J Med. 2019;381(4):307-316.
21. Dickler MN, Tolaney SM, Rugo HS, et al. MONARCH 1, een fase II-studie van abemaciclib, een CDK4- en CDK6-remmer, als single agent, bij patiënten met refractaire HR+/HER2-gemetastaseerde borstkanker. Clin Cancer Res. 2017;23(17):5218-5224.
22. Slee GW Jr, Toi M, Neven P, et al. MONARCH 2: abemaciclib in combinatie met fulvestrant bij vrouwen met HR+/HER2- gevorderde borstkanker die gevorderd waren terwijl ze endocriene therapie kregen. J Clin Oncol. 2017;35(25):2875-2884.
23. Slee GW Jr, Toi M, Neven P, et al. Het effect van abemaciclib plus fulvestrant op algehele overleving bij hormoonreceptor-positieve, ERBB2-negatieve borstkanker die progressie vertoonde tijdens endocriene therapie-MONARCH 2: een gerandomiseerde klinische studie. JAMA Oncol. 2020;6(1):116-124.
24. Goetz MP, Toi M, Campone M, et al. MONARCH 3: abemaciclib als initiële therapie voor gevorderde borstkanker. J Clin Oncol. 2017;35(32):3638-3646.
25. Johnston S, Martin M, Di Leo A, et al. MONARCH 3 final PFS: een gerandomiseerde studie van abemaciclib als initiële therapie voor gevorderde borstkanker. NPJ Breast Cancer. 2019;17(5):5.
26. FDA. FDA waarschuwt voor zeldzame maar ernstige longontsteking met Ibrance, Kisqali, en Verzenio voor borstkanker. www.fda.gov/drugs/drug-safety-and-availability/fda-warns-about-rare-severe-lung-inflammation-ibrance-kisqali-and-verzenio-breast-cancer. Geraadpleegd op 15 januari 2020.
27. Shah M, Nunes MR, Stearns V. CDK4/6 inhibitors: game changers in the management of hormone receptor-positive advanced breast cancer? Oncologie (Williston Park). 2018;32(5):216-222.
De inhoud van dit artikel is alleen voor informatieve doeleinden. De inhoud is niet bedoeld als vervanging van professioneel advies. Vertrouwen op enige informatie in dit artikel is uitsluitend op eigen risico.
