


Patiënten met neovasculaire leeftijdsgebonden maculadegeneratie vertonen met anti-VEGF-therapie doorgaans aanzienlijke verbeteringen van de gezichtsscherpte en de kwaliteit van leven. Hoewel de resultaten op korte termijn spectaculair zijn, zijn er nog steeds enkele belangrijke vragen over de langetermijnbehandeling van deze patiënten. Deze omvatten:
- Wat is het beste middel?
- Hoe vaak moet men behandelen?
- Veroorzaakt langdurige dosering van deze middelen verlies en beschadiging van het gezichtsvermogen?
- Zijn er nieuwe platforms in het verschiet voor langdurige toediening van deze middelen?
- Dit artikel beantwoordt deze vragen op basis van bevindingen van cruciale klinische trials.
Zijn alle anti-VEGF middelen gelijk? Hoe vaak moeten we behandelen?
In 2006 toonden de baanbrekende ANCHOR- en MARINA-studies de werkzaamheid en veiligheid aan van ranibizumab (Lucentis, Roche/Genentech) met maandelijkse dosering. Patiënten wonnen respectievelijk 10,7 en 6,6 letters na twee jaar.1-2 Vervolgens toonden de parallelle VIEW1 en VIEW2 studies een gemiddelde verbetering van het gezichtsvermogen na twee jaar met aflibercept (Eylea, Regeneron Pharmaceuticals) q8 weken na drie initiële maandelijkse laaddoses.3
Latere studies stelden ons in staat om de werkzaamheid van deze geneesmiddelen te evalueren met minder frequente doseringsintervallen, waaronder driemaandelijkse, pro re nata (PRN) en treat-and-extend regimes. De PIER-studie onderzocht driemaandelijkse doseringen met ranibizumab na drie maandelijkse laaddoses, en hoewel superieur aan observatie, verloren PIER-patiënten na één jaar 2,3 letters ten opzichte van de uitgangswaarde.4
Een van de vroegste uitzonderingen was PrONTO, een fase I/II-studie waarbij 40 patiënten gedurende twee jaar werden geëvalueerd met maandelijkse monitoring en PRN-retreatment op basis van gezichtsscherpte, klinisch onderzoek en optische coherentie tomografie-parameters.5 De gezichtsscherpteresultaten benaderden die van ANCHOR en MARINA met bijna de helft van het aantal injecties, maar in de studie ontbrak een maandelijkse behandelingscontrole-arm. Deze resultaten werden niet herhaald in latere PRN-studies.
De HARBOR-studie vergeleek maandelijkse en PRN-dosering van ranibizumab. De maandelijkse 0,5 mg groep won 9,1 letters na 24 maanden versus 7,9 letters voor de PRN-groep. Hoewel dit verschil statistisch niet significant was, was het mediane aantal injecties (maar niet het aantal bezoeken) verminderd van 21,4 tot 13,3.6
CATT en IVAN waren vergelijkbare studies die maandelijkse en PRN-dosering van ranibizumab en off-label bevacizumab (Avastin, Roche/Genentech) vergeleken. Na twee jaar bleek de PRN-dosering niet inferieur aan de maandelijkse behandeling in beide studies (behalve voor PRN bevacizumab in CATT), hoewel er een tendens was naar beter zicht in de maandelijkse groepen.7,8
TREX vergeleek maandelijkse ranibizumab met een treat-and-extend (T&E) regime.9 Ook hier was het verschil in gezichtsscherpte niet statistisch significant (10,5 in de maandelijkse groep en 8,7 in de T&E groep), maar er was een trend naar beter zicht in de maandelijkse groep. Het gemiddelde aantal injecties was 25,5 tegen 18,6 over twee jaar. Ook verloor geen enkele maandelijkse cohort patiënten meer dan 2 letters, terwijl vijf T&E patiënten ten minste 3 lijnen van het gezichtsvermogen verloren.
Hoewel deze studies statistisch vergelijkbare resultaten hebben laten zien met maandelijkse dosering op de korte termijn, zijn de absolute gegevensresultaten bijna unaniem superieur geweest met maandelijkse dosering van anti-VEGF middelen.
Wat gebeurt er na twee jaar?
De gegevens na twee jaar van deze klinische studies zijn niet zo gemakkelijk te interpreteren en toe te passen als de gegevens van de klinische studie, voornamelijk omdat deze uitbreidingsstudies hoofdzakelijk de veiligheid van het geneesmiddel op lange termijn evalueerden. De follow-up en de behandelingsschema’s waren dus niet zo rigoureus.

HORIZON was de uitbreidingsstudie voor patiënten in de MARINA-, ANCHOR- en FOCUS-studies. Deze patiënten volgden geen protocol; zij kregen een behandeling naar goeddunken van de onderzoekers tijdens evaluatiebezoeken om de drie tot zes maanden. Na vier jaar verloren de HORIZON-patiënten in wezen de aanvankelijke winst in gezichtsvermogen en vielen zij terug naar het gezichtsvermogen aan de basislijn (-0,1 letters).10 Verdere gegevensanalyse vond een verband tussen beter gezichtsvermogen en meer injecties.
De vijfjarige CATT-studie beoordeelde patiënten die werden gevolgd en behandeld naar goeddunken van de onderzoekers na de eerste twee jaar van de proef. Gemiddeld verloren de patiënten 3 letters in vergelijking met het basiszicht. De patiënten werden gemiddeld acht keer per jaar gezien en kregen gemiddeld vijf behandelingen per jaar.11 Er ontstond enige discussie over de vraag of het gezichtsverlies te wijten was aan onderbehandeling of aan de ontwikkeling van maculaire atrofie, maar de studie had geen vermogen om dit verschil uit te zoeken.12
De VIEW 1 uitbreidingsstudie controleerde de patiënten strenger. De deelnemers kregen een dosering met vaste intervallen >q8-weken, maar ze konden vaker worden behandeld als ze voldeden aan vooraf gespecificeerde criteria. Bij deze uitbreiding behielden de patiënten een veel beter gezichtsvermogen, met een gemiddeld gezichtsvermogen van 7,1 letters winst ten opzichte van de uitgangswaarde (vergeleken met een winst van 10,4 letters op het primaire eindpunt van één jaar).13
Wat gebeurt er op de lange termijn en maakt de doseringsfrequentie uit?

De beste langetermijngegevens die we hebben, zijn afkomstig van observationele studies. De SEVEN-UP-studie was een uitbreiding van de ranibizumab-onderzoeken. Hoewel er geen vooraf gespecificeerd bezoekschema of injectieprotocol was, verschaffen de gegevens toch enige informatie. Na zeven jaar hadden de patiënten gemiddeld 8,6 letters verloren ten opzichte van de uitgangswaarde. Patiënten die de volgende drie jaar geen injecties kregen, verloren 8,7 letters ten opzichte van de uitgangswaarde; patiënten die één tot vijf injecties kregen, verloren 10,8 letters; patiënten die zes tot tien injecties kregen, verloren 6,9 letters; en patiënten die meer dan 11 injecties kregen, wonnen 3,9 letters ten opzichte van de uitgangswaarde.14
De Fight Retinal Blindness Study Group uit Australië observeerde patiënten die gedurende zeven jaar met anti-VEGF werden behandeld. Deze patiënten verloren gemiddeld 2,6 letters ten opzichte van de uitgangswaarde, nadat ze na het tweede jaar gemiddeld vijf injecties per jaar hadden gekregen, toen ze 4 letters ten opzichte van de uitgangswaarde hadden gewonnen.15
Ten slotte was de FIDO-studie een waarnemingsstudie met één centrum, waarbij gedurende de eerste twee jaar vaste doses van q4 weken werden gebruikt en daarna van q8 weken. Deze patiënten wonnen 12,1 letters ten opzichte van de uitgangswaarde (van een piek van 16,1 letters na twee jaar) met een gemiddelde van 10,5 injecties per jaar.16
De centrale boodschap van deze observationele studies op lange termijn is dat meer injecties gemiddeld duidelijk tot een beter gezichtsvermogen leidden.
We beschikken nu over gegevens over 10 jaar
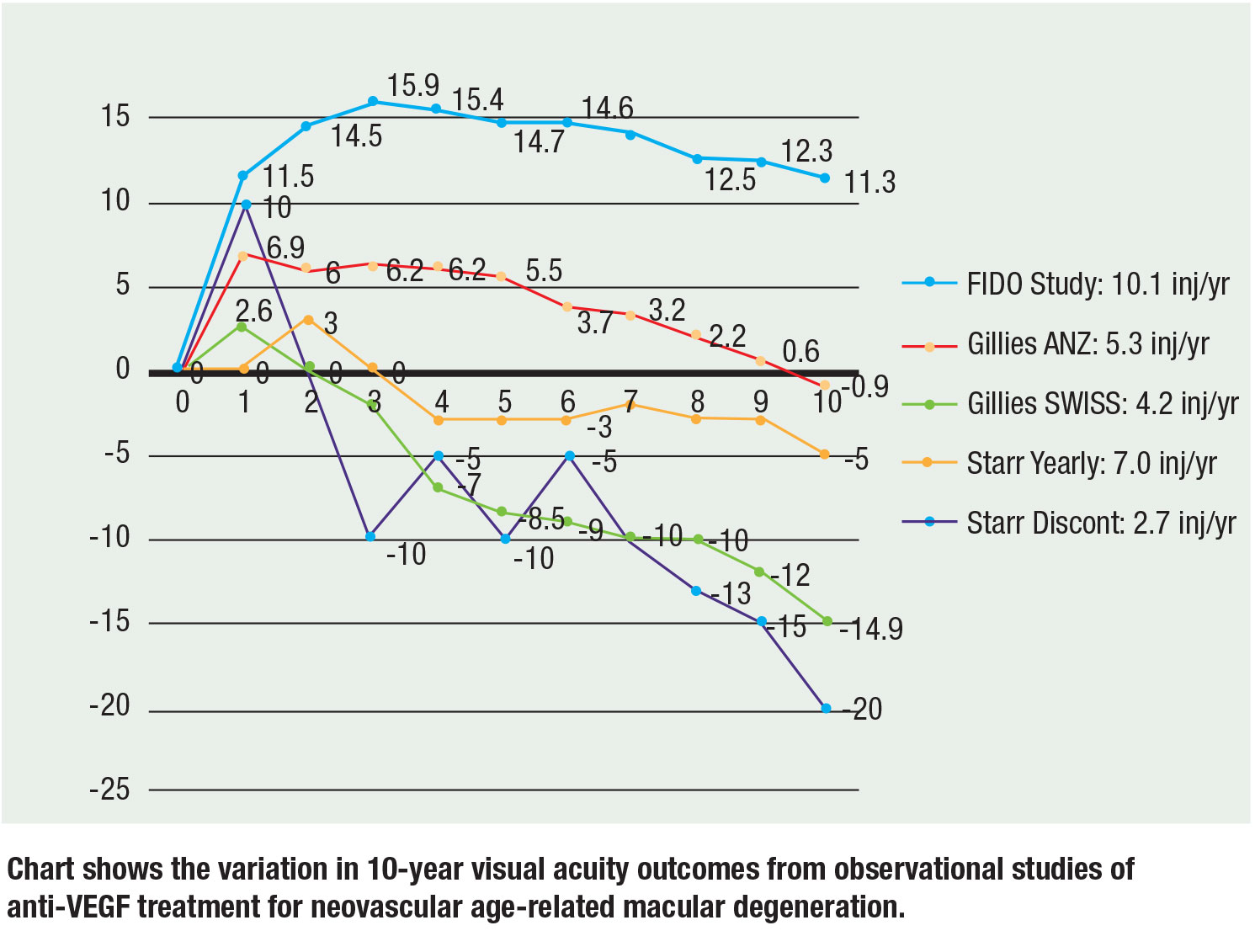
Nu hebben drie grote observationele studies gegevens over 10 jaar gerapporteerd en de resultaten blijven consistent: Meer injecties leiden tot een betere gezichtsscherpte. Mark Gillies, MD, en collega’s rapporteerden observationele gegevens uit Australië-Nieuw-Zeeland en Zwitserland. Bij de ANZ-patiënten was het gezichtsvermogen na 10 jaar gemiddeld met 0,9 letters afgenomen ten opzichte van de uitgangswaarde, met een mediaan van 5,3 injecties per jaar op een T&E-regime, vergeleken met de Zwitserse patiënten, bij wie het gezichtsvermogen gemiddeld met 14,9 letters was afgenomen, met een mediaan van 4,2 injecties per jaar op PRN. Hun conclusie was dat continue behandeling en meer injecties tot een beter gezichtsvermogen leidden.17
Matthew Starr, MD, en collega’s evalueerden een cohort dat patiënten omvatte die ten minste twee injecties hadden gehad. Gemiddeld kregen de patiënten vijf tot zeven injecties per jaar. Ogen die ten minste één injectie per jaar kregen, verloren ongeveer 7 letters ten opzichte van de uitgangswaarde, terwijl ogen die niet ten minste één injectie per jaar kregen, 15 letters ten opzichte van de uitgangswaarde verloren.18
Onze 10-jarige FIDO-cohort bereikte een gemiddelde toename van het gezichtsvermogen van 11,3 letters ten opzichte van een piek van 15,9 met een gemiddelde van 10,1 injecties per jaar gedurende de studieperiode.19
Het is belangrijk op te merken dat er inherente risico’s zijn met vergelijkingen tussen proeven gezien de verschillende aanvankelijke gezichtsscherpte en patiëntenpopulaties, maar de hellingen en trends houden vast aan de correlatie van meer injecties met een beter gezichtsvermogen. De figuur (blz. 29) geeft een samenvatting van de gegevens over 10 jaar van de drie proeven.
Leidt frequente behandeling tot progressie naar geografische atrofie?
De zorg over progressie van geografische atrofie met anti-VEGF behandeling is een punt van zorg geweest en een vaak aangevoerde reden om niet frequent te behandelen. Er zijn aanwijzingen dat het risico van gezichtsverlies door onderbehandeling veel groter is dan deze mogelijke zorg. De SEVEN-UP studie toonde een grotere incidentie van GA in andere ogen dan in ogen die behandeld werden met anti-VEGF.14
Bottom Line
Continue, regelmatige behandeling met anti-VEGF-middelen levert uitstekende resultaten op bij de behandeling van natte AMD. De langetermijngegevens tonen aan dat het risico van gezichtsverlies groter is bij onderbehandeling dan bij continue behandeling met regelmatige tussenpozen, zoals momenteel wordt toegepast bij doseringen met vaste tussenpozen of conservatieve “treat-and-extend”-schema’s. Platformen voor toediening op lange termijn, zoals het port-delivery system en gentherapie, lijken veelbelovend in het verminderen van de barrières van niet-naleving, de last van frequente bezoeken en de uitdagingen van variabele individuele doseringsvereisten. RS
1. Brown DM, Kaiser PK, Michels M, et al. Ranibizumab versus verteporfin voor neovasculaire leeftijdsgebonden maculadegeneratie. N Engl J Med. 2006;355:1432-1444.
2. Rosenfeld PJ, Brown DM, Heier JS, et al. MARINA Study Group, Ranibizumab for neovascular age-related macular degeneration. N Engl J Med. 2006;355:1419-1431.
3. Schmidt-Erfurth U, Kaiser PK, Korobelnik JF, et al. Intravitreal aflibercept injection for neovascular age-related macular degeneration: ninety-six-week results of the VIEW studies. Oogheelkunde. 2014;121:193-201.
4. Regillo CD, Brown DM, Abraham P, et al. Randomized, double-masked, sham-controlled trial of ranibizumab for neovascular age-related macular degeneration: PIER Studie jaar 1. Am J Ophthalmol. 2008;145:239-248.
5. Lalwani GA, Rosenfeld PJ, Fung AE, et al. A variable-dosing regimen with intravitreal ranibizumab for neovascular age-related macular degeneration: year 2 of the PrONTO Study. Am J Ophthalmol. 2009;148:43-58.
6. Ho AC, Busbee BG, Regillo CD, et al, for the HARBOR Study Group. Twenty-four-month efficacy and safety of 0.5 or 2.0 mg ranibizumab in patients with subfoveal neovascular age-related macular degeneration. Oogheelkunde. 2014;121:2181-2192.
7. Martin DF, Maguire MG, Fine SL, et al, voor de Comparison of Age-related Macular Degeneration Treatments Trials (CATT) Research Group. Ranibizumab and bevacizumab for treatment of neovascular age-related macular degeneration: two-year results. Oogheelkunde. 2012;119:1388-1398.
8. Chakravarthy U, Harding SP, Rogers CA, et al. Alternative treatments to inhibit VEGF in age-related choroidal neovascularization: 2-year findings of the IVAN randomized control trial. Lancet. 2013;382:1258-1267.
9. Wykoff CC, Ou WC, Brown DM, et al. Randomized trial of treat-and-extend versus monthly dosing for neovascular age-related macular degeneration: 2–year results of the TREX-AMD study. Ophthalmol Retina. 2017;1:314-321.
10. Singer MA, Awh CC, Sadda S, et al. HORIZON: An open-label extension trial of ranibizumab for choroidal neovascularization secondary to age-related macular degeneration. Ophthalmology. 2012;119:1175-1183.
11. Maguire MG, Martin DF, Ying GS, et al. Five-year outcomes with anti-vascular endothelial growth factor treatment of neovascular age-related macular degeneration: The comparison of age-related macular degeneration treatments trials. Ophthalmology. 2016;123:1751-1761.
12. Grunwald JE, Pistilli M, Ying GS, et al. Growth of geographic atrophy in the comparison of age-related macular degeneration treatments trials. Ophthalmology. 2015;122:809-816.
13. Kaiser PK, Singer M, Tolentino M, et al. Lange-termijn veiligheid en visueel resultaat van intravitreale aflibercept in neovasculaire leeftijdsgebonden maculadegeneratie. Ophthalmol Retina. 2017;1:304-313.
14. Rofagha S, Bhisitkul RB, Boyer DS, Sadda SR, Zhang K, for the SEVEN-UP Study Group. et al. Seven-year outcomes in ranibizumab-treated patients in ANCHOR, MARINA, and HORIZON: A multicenter cohort study (SEVEN-UP). Ophthalmology. 2013;120:2292-2299.
15. Gillies MC, Campain A, Barthelmes D, et al, voor de Fight Retinal Blindness Study Group. Long-term outcomes of treatment of neovascular age-related macular degeneration: Gegevens van een observationele studie. Ophthalmology. 2015;122:1837-1845.
16. Peden MC, Suñer IJ, Hammer ME, Grizzard WS. Long-term outcomes in eyes receiving fixed-interval dosing of anti-vascular endothelial growth factor agents for wet age-related macular degeneration. Ophthalmology. 2015;122:803-808.
17. Gillies M, Arnold J, Bhandari S, et al. Tien-jaars uitkomsten van neovasculaire leeftijdsgebonden maculadegeneratie uit twee regio’s. Am J Ophthalmol. 2020;210:116-124.
18. Starr MR, Kung FF, Bui YT, et al. Ten-year follow-up of patients with exudative age-related macular degeneration treated with intravitreal anti-vascular endothelial growth factor injections. Retina. Published online November 13, 2019.
19. Suñer IJ, Peden MC, Hammer ME, Grizzard WS. Ten-year outcomes in eyes receiving fixed-interval dosing of anti-vascular endothelial growth factor agents for wet age-related macular degeneration. Paper gepresenteerd op Retina Society 2019; 12 september 2019; Londen, U.K.
20. Campochiaro PA, Marcus DM, Awh CC, et al. Het port delivery system met ranibizumab voor neovasculaire leeftijdsgebonden maculadegeneratie: resultaten van de gerandomiseerde fase 2 LADDER klinische studie. Ophthalmology. 2019;126:1141-1154.
21. Ho AC; de Janssen/ORBIT Studiegroep. Precisie toedieningsprogramma’s voor cel- en gentherapie. Paper gepresenteerd op: Vail Vitrectomy Meeting; February 10, 2019; Vail, CO.
22. ADVM-022 gentherapie voor natte AMD (OPTIC). Sponsor: Adverum Biotechnologies. ClinicalTrials.gov Identifier: NCT03748784. Beschikbaar op: https://clinicaltrials.gov/ct2/show/NCT03748784. Accessed April 18, 2020.
23. RegenxBio meldt financiële en bedrijfsresultaten over het eerste kwartaal van 2019 en aanvullende positieve tussentijdse fase I/IIa-studie-update voor RGX-314 voor de behandeling van natte AMD . Rockville, MD; 7 mei 2019. https://www.prnewswire.com/news-releases/regenxbio-reports-first-quarter-2019-financial-and-operating-results-and-additional-positive-interim-phase-iiia-trial-update-for-rgx-314-for-the-treatment-of-wet-amd-300845423.html Geraadpleegd op 9 juli 2020.
