Inleiding
Chronische obstructieve longziekte (COPD) is een belangrijke oorzaak van sterfte en morbiditeit in de moderne wereld. Het sterftecijfer van deze ziekte neemt toe en voorspeld wordt dat het in 2020 wereldwijd de derde doodsoorzaak zal zijn.1 Het is niet mogelijk om COPD uitsluitend op basis van het geforceerde expiratoire volume in de 1s (FEV1) te definiëren, dus heeft het Global Initiative for Chronic Obstructive lung Disease (GOLD) een multidimensionale definitie ontwikkeld om COPD te beoordelen.2 De nieuwe definitie omvat naast de FEV1-waarde ook de prevalentie van symptomen en de voorgeschiedenis van exacerbaties, en legt tevens de nadruk op de beoordeling van comorbiditeiten. Voor de beoordeling van de symptomen wordt de aangepaste Medical Research Council (mMRC) of de COPD Assessment Test (CAT) aanbevolen. Bovendien werd een ziektespecifieke schaal voor levenskwaliteit (SGRQ, SF-36, CCQ) gebruikt om de impact van de ziekte op het dagelijkse leven te evalueren. Sommige studies hebben een sterke relatie aangetoond tussen CAT en de St. George’s Respiratory Questionnaire (SGRQ).3,4 Ladeira et al.5 toonden aan dat CAT gecorreleerd was met de BODE-index.
COPD is een complexe ziekte en omvat genetische, cellulaire en moleculaire componenten. Er zijn veel verschillende cellen en moleculen betrokken bij de ontstekingswegen. Verschillende indicatoren zijn gebruikt om een mogelijke ziektegerelateerde systemische ontsteking aan te tonen.6-9 Luchtweg- en longparenchymontsteking is een belangrijk pathogeen mechanisme van COPD. Bovendien kan persisterende systemische ontsteking geassocieerd worden met verschillende extrapulmonale comorbiditeiten en pulmonale effecten.10 Recent onderzoek heeft het bestaan aangetoond van een apart “nieuw systemisch inflammatoir COPD fenotype”. 7 In een recente studie werd aangetoond dat cardiovasculaire comorbiditeit en diabetes geassocieerd waren met hogere niveaus voor sommige markers van systemische ontsteking.11 Daarom zijn genetische belasting, systemische ontsteking en comorbide ziekten geassocieerd met verschillende fenotypes in COPD. Het is van essentieel belang dat er nieuwe perspectieven worden ontwikkeld voor het beheer van deze ziekte.
Huidig wordt CAT steeds meer gebruikt voor het beoordelen en monitoren van COPD. Hoewel er verschillende serum biomarkers bij COPD zijn gedefinieerd, is er niet één enkele voldoende en effectieve biomarker die kan worden gebruikt om de status van COPD-patiënten te beoordelen. Het is aangetoond dat biomarkers geassocieerd zijn met verschillende parameters zoals ontsteking, hospitalisatie en mortaliteit.7-13 De relatie tussen CAT en biomarkers is echter niet duidelijk aangetoond. Daarom heeft de huidige studie tot doel de niveaus van systemische ontsteking bij COPD te onderzoeken en de relatie tussen CAT en ontstekingsmarkers en kwaliteit van leven te bepalen.
Materialen en methodenStudieopzet
Dit was een cross-sectionele observationele studie met één bezoek. Honderdtien patiënten met COPD gediagnosticeerd volgens de GOLD-criteria14 en vijfenzestig controlepersonen werden gerekruteerd tussen februari 2013 en augustus 2013. Controlepersonen werden gekozen uit degenen die verwezen werden naar een pulmonologie en interne geneeskunde kliniek van het Balikesir Universiteitsziekenhuis, die routineonderzoeken ondergingen. Schriftelijke geïnformeerde toestemming werd verkregen van alle deelnemers en de studie werd goedgekeurd door de Institutionele Ethische Commissie van de Faculteit Geneeskunde van de Balikesir Universiteit.
Alle patiënten werden onderworpen aan lichamelijk onderzoek, röntgenfoto’s van de borstkas, ademhalingsfunctietests en routinematige bloedanalyses. Het aantal exacerbaties in het voorgaande jaar en de voorgeschiedenis van roken werden geregistreerd. De CAT, mMRC dyspnea score werd uitgevoerd via face-to-face interviews door longspecialisten. De SGRQ-scores werden door de patiënten gerapporteerd. Voor de gezonde controlegroep werden alleen een ademhalingsfunctietest en routinematig bloedonderzoek gedaan.
De populatie van het onderzoek
Inclusiecriteria: Patiënten werden geïncludeerd indien zij: (1) ouder waren dan 40 jaar; (2) huidige of ex-rokers waren met een rookgeschiedenis ≥10 pack-jaren; (3) een post-bronchodilator FEV1
80% en een FEV1/FVC0.7 vertoonden. Controlepersonen werden geïncludeerd indien zij: (1) ouder waren dan 40 jaar; (2) vrij waren van longziekte zoals vastgesteld door een arts; (3) een normale spirometrie hadden (FEV1>85% en FEV1/FVC>0,7); en (4) een rookgeschiedenis hadden van
Exclusiecriteria: Patiënten werden uitgesloten die; (1) een exacerbatie van COPD hadden in de voorgaande 6 weken; (2) een andere ademhalingsaandoening hadden dan COPD of maligniteit; (3) een chronische ontstekingsziekte hadden (vasculitis, inflammatoire darmziekte, reumatoïde artritis enz.) (4) had ongecontroleerde of ernstige bijkomende ziekte (MI, aritmie enz.).
Metingen
Demografische kenmerken, leeftijd, geslacht, rookgewoonten, opname op een spoeddienst of ziekenhuisopname in het afgelopen jaar, begeleidende ziekten, en bestaande behandelingen werden allemaal op de juiste manier geregistreerd. Wij definieerden een exacerbatie als verergering van de symptomen waarvoor orale corticosteroïden en/of antibiotica en/of ziekenhuisopname nodig waren. Comorbide ziekten werden vastgesteld aan de hand van de klinische voorgeschiedenis en de bevindingen bij het lichamelijk onderzoek tijdens het bezoek en werden ondersteund door een controle van de beschikbare medische dossiers. Huidige medicatie inclusief inhalers, antihypertensiva of andere medicatie werden gedocumenteerd. De lengte, het gewicht en de BMI indexen werden gemeten, en een spirometrie werd ook uitgevoerd in overeenstemming met de internationale richtlijnen (ATS/ERS).15 De ziekte werd geclassificeerd volgens de oude en nieuwe versie van GOLD stadiëring.14 Ten eerste, GOLD spirometrische stadiëring (FEV1 gebaseerd (1-4) stadiëring) en ten tweede, GOLD stadiëring (A-D klasse). Dyspneu werd beoordeeld met de mMRC-dyspneuschaal.16 De patiënten met COPD werden ingedeeld in A, B, C en D met een combinatie van symptoombeoordeling door mMRC-dyspneuscores en exacerbatierisico.
CAT: De validiteit en betrouwbaarheid van de Turkse versie van deze schaal zijn eerder geverifieerd.17 De CAT omvat 8 items en levert totaalscores op variërend van 0 tot 40; hogere scores wijzen op een ernstiger verslechtering van de gezondheidstoestand of een minder succesvolle beheersing van COPD.3
Quality of life Questionnaire: De kwaliteit van leven werd beoordeeld met behulp van de Turkse vertaling van de St. George’s Respiratory Diseases Questionnaire (SGRQ).18
Biomarkers
We kozen de biomarkers op basis van eerdere studies.7,9-13 De bloedmonsters die bij alle proefpersonen werden afgenomen, werden gecentrifugeerd en bewaard bij -80°C. Alle monsters werden geanalyseerd wanneer de studie was voltooid. Het serum werd onderzocht in een diagnostisch apparaat (BioTek, ELx 800, USA) met gebruik van commerciële kits (eBioscience, Human TNF-α en Human IL-6 Platinum ELISA, Oostenrijk), en met de methoden van tumornecrose-alfa (TNF-α) en een interleukine-6 (IL-6) niveau enzyme linked immunosorbent assay (ELISA). De niveaus van C-reactief proteïne (CRP) werden geëvalueerd met een klinisch-chemisch analyseapparaat (Cobes Integra 800, Roche diagnostics) met behulp van een commerciële kit. De referentiewaarde van CRP is 0-0,5mg/L, terwijl de laagste geanalyseerde waarde van IL-6 0,92pg/ml is. De laagste geanalyseerde waarde van TNF-α is 2,3 pg/ml. De TNF-α- en IL-6-concentraties van sommige monsters lagen onder de ondergrens van de kwantificering (LLQ). In de analyse van individuen met waarden onder de LLQ, werd een nominaal niveau van de helft van de LLQ waarde gebruikt om een neerwaartse bias van de populatiegegevens te vermijden.19
Statistische analyse
De gemiddelde CRP waarden van COPD en controlegroepen (3,2 (1,5,7,1), 1,3 (0,6,2,7)) werden geïdentificeerd uit gelijkaardige studies.7 Daarna werd in elke groep de steekproefgrootte berekend door gebruik te maken van de gemiddelde berekeningsformule met 80% nauwkeurigheid en 5% fout. Dienovereenkomstig werd de steekproefgrootte vastgesteld op ten minste 55 proefpersonen in elke groep. De resultaten worden gepresenteerd als gemiddelde±SD, mediaan, of percentage, al naar gelang het geval. De Student’s t-test en ANOVA werden gebruikt voor parametrische tests; de Mann-Whitney U-test, Kruskal-Wallis en chi-kwadraatstatistieken werden gebruikt voor niet-parametrische tests voor groepsvergelijkingen. Fisher’s exact test evalueerde de verschillen tussen de percentages comorbiditeiten en de verschillen tussen de geslachten. De chi-kwadraat toets evalueerde de verschillen tussen de percentages comorbiditeiten. Paarsgewijze correlatie van continue variabelen bij patiënten met COPD werd onderzocht door Pearson correlatie. Een waarde van p
0,05 werd als statistisch significant beschouwd. Alle statistische analyses werden uitgevoerd met de SPSS (versie 20.0) software.ResultatenKlinische karakterisering van de proefpersonen
De studie omvatte 110 patiënten (gemiddelde leeftijd van 64±8,9 jaar; 100 mannen (90,9%)), en 65 controlepersonen (gemiddelde leeftijd van 61,5±9,2 jaar, 55 mannen (84,6%)). De demografische en klinische karakteristieken van de patiënten- en controlegroepen staan vermeld in Tabel 1. Vijfenveertig (40,9%) patiënten met COPD hadden een begeleidende ziekte (Ischemische hartziekte (n=21), hypertensie (n=13), diabetes mellitus (n=8), overig (n=3)). De gemiddelde FEV1 was 48,8% van de voorspelde waarde en de gemiddelde FEV1/FVC: 55,4% in de COPD groep. De gemiddelde CAT-score was 22,6 (±9,2), mMRC: 1,9 (±0,9) en totale SGRQ: 58,4 (±22,2). Van de 110 patiënten was 9,1% stadium 1, 37,3% stadium 2, 42,7% stadium 3 en 10,9% stadium 4 volgens de GOLD spirometrische stadiëring. Wanneer de patiënten werden ingedeeld volgens de GOLD stadiëring, waren 27,3% groep A, 30,9% groep B, 7,3% groep C en 34,5% groep D.
Demografische, functionele, klinische kenmerken van de patiënten- en controlegroepen.
| Patiënt (n=110) | Controle (n=65) | p-waarde | |
|---|---|---|---|
| Leeftijd | 64.0±8.9 | 61.5±9.2 | 0.080 |
| Mannelijk n, (%) | 100 (90.9) | 55 (84.6) | 0.224 |
| BMI, kg/m2 | 26.5±5.6 | 25±2.6 | 0.064 |
| Pakjaren | 38,9±23 | 0,1±1,2 | |
| Co-morbiditeiten, n (%) | |||
| Enige | 65 (59.1) | 42 (64,6) | 0,95 |
| Ischemische hartziekte | 21(19,1) | 11 (16,9) | |
| HT | 13 (11.8) | 6 (9.2) | |
| DM | 8 (7.3) | 4 (6.2) | |
| Overige | 3 (2.7) | 2 (3,1) | |
| mMRC | 1,94±0,9 | 0,04±0,2 | |
| FEV1, % voorspeld | 48,8±17.8 | 89.4±5.6 | |
| FVC, % voorspeld | 68.7±17.8 | 92.1±5.8 | |
| FEV1/FVC, % | 55.4±12.9 | 89.6±4.7 | |
| GOLD spirometrische fase, n (%) | |||
| 1 | 10 (9.1) | ||
| 2 | 41 (37.3) | ||
| 3 | 47 (42.7) | ||
| 4 | 12 (10.9) | ||
| GOLD stadium, n (%) | |||
| A | 30 (27.3) | ||
| B | 34 (30.9) | ||
| C | 8 (7.3) | ||
| D | 38 (34.5) | ||
| SGRQ-totaalscore | 58,4±22,2 | ||
| CAT-score | 22.6±9.2 | ||
| TNFα (pg/ml) | 109.5±58 | 14.6±18 | |
| IL-6 (pg/ml) | 10.3±18 | 2,14±1,9 | |
| CRP (mg/L) | 1,6±1,7 | 0,4±0,3 | |
Afkortingen: BMI: body mass index, HT: hypertensie, DM: diabetes, FEV1: geforceerd expiratoir volume in 1 seconde, FVC: geforceerde vitale capaciteit, CAT: COPD assessment test.
COPD/controle vergelijkingen
Er was geen significant verschil tussen de leeftijden (p=0,080, Student’s t-test) en geslachten van de twee groepen (p=0,453, Fisher’s exact test) (Tabel 1). De groepen vertoonden vergelijkbare incidentie van comorbiditeiten (p=0,095, χ2 test). Zoals verwacht hadden COPD-patiënten significant lagere longfunctieparameters (FEV1, FVC, FEV1/FVC) in vergelijking met controles (p
0,001, Student’s t-test). In het algemeen vertoonden COPD-patiënten hogere serumspiegels van CRP (1,6±1,7mg/L) en TNF-α (109,5±58pg/ml) en IL-6 (10,3±18pg/ml) dan gezonde controles (CRP: 0,4±0,3mg/L, p0,001; TNF-α: 14,6±18pg/ml, p0,001; IL-6: 2,14±1,9pg/ml, p0,001, Student’s t-test) (Tabel 1).Associatie van CAT-vragenlijsten en patiëntkenmerken
Er was een correlatie tussen de CAT-score en de GOLD spirometrische fase (Pearson’s r=0,43; p
0,001). De CAT-score steeg parallel met de ernst van de ziekte. Er was een statistisch significant verband tussen de CAT-score en het aantal exacerbaties in het voorgaande jaar (Pearson’s r=0,35, p0,001), ziekteduur (Pearson’s r=0,29, p0,001), roken (pack-jaar) (Pearson’s r=0,27, p=0,014) en mMRC (Pearson’s r=0,59, p0,001). De CAT-score bleek significant gecorreleerd te zijn met FEV1 (Pearson’s r=-0,39, p0,001) en FVC (Pearson’s r=-42, p=0,003). Tegelijkertijd werd een sterke correlatie waargenomen tussen de CAT-score en de SGRQ symptoom-, activiteit-, impact- en totaalscores (Pearson’s r=0,72; p0,001).Associatie tussen biomarkers en patiëntkenmerken
Inflammatoire markers en longfunctieparameters werden vergeleken. Naarmate de FEV1 afnam, namen de niveaus van biomarkers significant toe. CRP niveaus waren gecorreleerd met FEV1 (Pearson’s r=-0.39, p
0.001), FVC (Pearson’s r=-0.33, p0.001) en FEV1/FVC (Pearson’s r=-0.38, p0.001). TNF-α niveaus waren ook gecorreleerd met FEV1 (Pearson’s r=-0.57, p0.001), FVC (Pearson’s r=-0.37, p0.001) en FEV1/FVC (Pearson’s r=-0.66, p0.001). IL-6 niveaus waren ook gecorreleerd met FEV1 (Pearson’s r=-0.31, p0.001), FVC (Pearson’s r=-0.32, p0.001) en FEV1/FVC (Pearson’s r=-0.34, p0.001). Er werd een significant verband waargenomen tussen CRP, TNF-α, IL-6 en roken (pack-jaar) (Pearson’s r=0.35, r=0.44, r=0.27, p0.001, respectievelijk). COPD-patiënten met hart- en vaatziekten hadden een verhoogd niveau van CRP (2,98±2.4mg/L) vergeleken met patiënten zonder comorbiditeiten (1,56±1,5mg/L, p=0,008 ANOVA test gevolgd door LSD post hoc test). Er was geen significant verband met andere biomarkers en comorbiditeiten. Naarmate de IL-6 toenam, nam de mMRC score toe, maar deze relatie was niet statistisch significant (p=0,06). Wanneer ontstekingsmarkers werden vergeleken met de CAT-score, bleek CRP-niveaus een significante correlatie te hebben (r=0,43, p0,001) (Fig. 1) terwijl geen correlatie werd waargenomen met TNF-α en IL-6. Er was een correlatie tussen CRP niveaus en TNFα (r=0,48, p0,001). Er werd geen direct verband waargenomen tussen biomarkers en A-D klasse of spirometrische stadia.
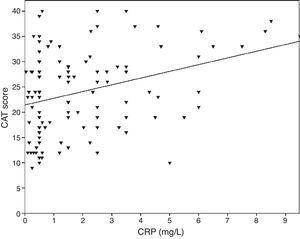
De relatie tussen CAT-scores en CRP (r=0,43, p0,001).
Discussie
Een aantal beoordelingsinstrumenten wordt gebruikt zoals klinische tests (CAT, BODE), ontstekingsmarkers en vragenlijsten voor de kwaliteit van leven om COPD te evalueren. Het is algemeen aanvaard dat een multidimensionele beoordeling nodig is om de ziekte te begrijpen en te beheersen. COPD is een complexe aandoening met een systemische component en sommige patiënten blijken een inflammatoir fenotype te hebben. In deze studie werd CAT uitgevoerd als een nieuwe klinische test, en de relatie van CAT met andere COPD componenten werd onderzocht.
Een van deze componenten is systemische ontsteking. De biomarkers die het vaakst bij COPD worden gebruikt om systemische ontsteking aan te geven, zijn CRP, IL-6, TNF-α, IL-8 en fibrinogeen. Verschillende studies hebben reeds verhoogde circulerende niveaus van deze markers gerapporteerd bij patiënten met stabiele COPD.6-9,20-23 In een recente studie toonden Agustí et al. aan dat 30% van de COPD-patiënten geen bewijs van systemische ontsteking vertoonde en 16% van de patiënten wel persisterende systemische ontsteking.7 Interessant in deze studie was dat de serumniveaus van TNF-α en IL-8 hoger bleken te zijn bij rokers met normale spirometrie in vergelijking met COPD-patiënten. De andere markers zoals witte bloedcellen, IL-6, CRP en fibrinogeen bleken hoger te zijn bij COPD-patiënten dan bij rokers met normale spirometrie en niet-rokers. In onze studie waren de niveaus van CRP, TNF-α, IL-6 significant hoger bij alle COPD-patiënten in vergelijking met de controlegroep. Alle biomarkers bleken gecorreleerd te zijn met de cumulatieve blootstelling aan roken en de vermindering van longfunctietestparameters (FEV1, FVC, en FEV1/FVC). Het niveau van de biomarkers houdt verband met de mate van luchtstroomobstructie. Deze resultaten komen overeen met die gerapporteerd in eerdere cross-sectionele studies.13 In een andere studie waarin de resultaten van ECLIPSE werden onderzocht, waren cardiovasculaire comorbiditeiten en diabetes gecorreleerd met een aantal systemische ontstekingsmarkers.9 In onze studie hadden COPD-patiënten met cardiovasculaire aandoeningen een verhoogd niveau van CRP in vergelijking met patiënten zonder comorbiditeiten. Verhoogde systemische ontsteking bij COPD met hart- en vaatziekten ondersteunt een pathofysiologisch mechanisme tussen COPD en deze comorbiditeiten.
De relatie tussen CAT en systemische ontsteking is niet opgehelderd door de tot nu toe uitgevoerde studies. In één studie werd een significante correlatie aangetoond tussen LCN1, LCN2 en CAT.8 In onze studie werd een significante relatie aangetoond tussen CAT en CRP. Een soortgelijke correlatie kon echter niet worden aangetoond met TNF-α en IL-6.
In de huidige studie werden COPD-patiënten ingedeeld in vier groepen (A-D) en stadia (1-4) volgens de oude en nieuwe versie van de GOLD-classificatie. Men kan vaststellen dat stadium 1 en stadium 4 het kleinste deel van de populatie uitmaken met elk 10% volgens de oude classificatie. In de nieuwe versie was de populatie bijna gelijk verdeeld over de groepen A, B en D; de kleinste verdeling was die van groep C. In andere studies is ook aangetoond dat groep C het kleinste deel van de verdeling uitmaakt.24,25 De nieuwe classificatie geeft aan dat er zowel patiënten kunnen zijn met meerdere symptomen maar met milde luchtwegobstructie als patiënten met weinig symptomen maar met ernstige luchtwegobstructie. Comorbiditeiten en systemische ontsteking kunnen leiden tot toename van exacerbatie en symptomen bij patiënten met milde/matige obstructie, en op deze manier zorgt het ervoor dat deze patiënten in de hoogrisicogroepen (C- of D-klasse) worden geplaatst. In een studie werd aangetoond dat subtype C patiënten omvat met een hogere comorbiditeitstatus en subtype D patiënten omvat met de ernstigste exacerbatie, een hoog percentage exacerbaties met ziekenhuisopname en de slechtste uitkomsten.26 In een recente studie vergeleken Agustí et al. twee groepen met en zonder persisterende systemische ontsteking en toonden aan dat patiënten met persisterende ontsteking tijdens de follow-up meer exacerbaties per jaar hadden in vergelijking met de andere groep, hoewel de longafwijkingen in deze twee groepen vergelijkbaar waren.7
GOLD beveelt het gebruik van CAT- of mMRC-schaal aan om de symptomen te beoordelen. Wij gebruikten de mMRC-schaal voor de groepstoewijzing, omdat wanneer wij de symptomen op basis van CAT bekeken, het aantal van de patiënten met minder dan 10 breekpunten zeer klein was (8 patiënten). De hogere CAT-scores kunnen in verband worden gebracht met de hogere percepties van de symptomen van de patiënten. Ook werd aangetoond dat CAT en mMRC niet gelijkwaardig zijn, en dit kan leiden tot enkele verschillen in de classificatie.24,25,27 In de nieuwe classificatie zijn de andere afkappunten samengesteld uit het aantal exacerbaties per jaar. De relatie tussen de basale CAT-score en de frequentie van exacerbaties werd aangetoond bij COPD-patiënten.28 Pothirat et al. hebben aangetoond dat de verandering in CAT-score tijdens controlebezoeken een nuttig instrument is voor het detecteren van acute verslechtering van de gezondheidstoestand van COPD-patiënten.29 In onze studie werd een sterke relatie waargenomen tussen CAT, mMRC en het aantal exacerbaties. De CAT bleek ook gecorreleerd te zijn met de ziekteduur, en roken (pack-jaar). De gemiddelde FEV1 van de patiënten bleek 48,8% van de voorspelde waarde te zijn en de gemiddelde CAT-score was 22,6. Er werd een sterk verband aangetoond tussen CAT en FEV1, FVC en de GOLD spirometrische fase. Naarmate de FEV1 en FVC afnamen, nam de CAT-score toe. De CAT score correleerde ook positief met een zwaarder GOLD stadium. Deze resultaten tonen aan dat CAT de ernst van de ziekte zeer goed weergeeft.
Een ander belangrijk onderdeel van COPD management is de kwaliteit van leven. Een verscheidenheid aan levensvragenlijsten zijn gebruikt om de effecten van de ziekte op het dagelijks leven te evalueren. De betrouwbaarheid en validiteit van de Turkse versie van de SGRQ zijn bewezen.30 Enkele studies hebben aangetoond dat er een significante correlatie is tussen CAT en SGRQ.3,4 In een studie is gerapporteerd dat CAT gevoelig is voor de verandering in gezondheidsstatus geassocieerd met COPD exacerbaties.31 In onze studie werd een sterke relatie aangetoond tussen CAT en SGRQ. Aangezien CAT, vergeleken met SGRQ, een kortere en gemakkelijker te begrijpen test is, is het gebruik van CAT praktischer.
De huidige studie heeft verschillende beperkingen, zoals de cross-sectionele opzet, een studie in één centrum en een kleine steekproefgrootte. Bovendien konden de ontstekingsmarkers niet worden vergeleken bij rokers die een normale longfunctie hebben, omdat zij niet in de huidige studie waren opgenomen. De medicatie voor patiënten kan een invloed uitoefenen op de systemische ontstekingsreactie en de gezondheidsstatus en zij kunnen ook de resultaten beïnvloeden.
Samenvattend is CAT een test die kan worden gebruikt bij de beoordeling van COPD, aangezien de betrouwbaarheid en de validiteit ervan duidelijk zijn aangetoond. De resultaten van onze studie wijzen op de relatie tussen CAT en CRP, evenals andere COPD-componenten (klinische, functionele parameters). Longitudinale multicenter studies zijn echter nodig om de relatie tussen CAT en biomarkers te evalueren.
Ethische openbaarmakingenBescherming van menselijke en dierlijke proefpersonen
De auteurs verklaren dat voor deze studie geen experimenten zijn uitgevoerd op mensen of dieren.
Geheimhouding van gegevens
De auteurs verklaren dat zij de protocollen van hun werkcentrum over de publicatie van patiëntengegevens hebben gevolgd en dat alle in de studie opgenomen patiënten voldoende informatie hebben ontvangen en schriftelijke geïnformeerde toestemming hebben gegeven om aan de studie deel te nemen.
Recht op privacy en geïnformeerde toestemming
De auteurs hebben de schriftelijke geïnformeerde toestemming verkregen van de in het artikel genoemde patiënten of proefpersonen. De corresponderende auteur is in het bezit van dit document.
Auteurschap
Studieopzet: NS, FE en AAH; Gegevensverzameling: NS, CB; Analyse en interpretatie van de gegevens: NS, AAH, en CB; kritische revisie van het manuscript: NS, FE, CB en AAH.
Belangenverstrengeling
De auteurs verklaren dat zij geen belangenverstrengeling hebben bij het opstellen van dit manuscript.
