- Wat is Entropie?
- Wat is de Derde Wet Van Thermodynamica?
- Belang van de derde wet van de thermodynamica
De derde wet van de thermodynamica stelt dat als de temperatuur van een systeem het absolute nulpunt nadert, de entropie constant wordt, of de verandering in entropie nul is. De derde wet van de thermodynamica voorspelt de eigenschappen van een systeem en het gedrag van de entropie in een unieke omgeving die bekend staat als absolute temperatuur.
De entropie van een begrensd of geïsoleerd systeem wordt constant als de temperatuur ervan absolute temperatuur (absoluut nulpunt) nadert.
Thermodynamica is een van de belangrijkste en meest bestudeerde takken van de natuurwetenschappen. Behalve dat het studenten werktuigbouwkunde het grootste deel van hun academische leven kwelt, is het alomtegenwoordig, van de koude bries van mijn airconditioner tot een van de hoogtepunten van het industriële tijdperk – de stoommachine. De toepassing ervan wordt beheerst door drie wetten, die bekend staan als de Wetten van de Thermodynamica. Deze wetten bepalen hoe arbeid, warmte en energie een systeem beïnvloeden. Een systeem is elk gebied in het heelal dat eindig begrensd is en waarlangs energie wordt overgedragen. Alles buiten deze begrenzing is zijn omgeving.
Illustratie van een systeem in de thermodynamica. (Photo Credit : Wavesmikey / Wikipedia Commons)
Wat is entropie?
Terwijl de eerste wet van de thermodynamica impliceert dat het heelal begon met eindige bruikbare energie, waarbij een systeem dat energie onttrekt deze deels zal besteden aan het verrichten van arbeid en deels aan het verhogen van de inwendige temperatuur, gaat de tweede wet in op de implicaties hiervan. Dit omvat de omzetting van deze eindige bruikbare energie in onbruikbare energie; bijvoorbeeld de vorming van materie die miljarden jaren geleden plaatsvond als gevolg van de condensatie van energie waarmee het heelal begon. In dit proces wordt de eindige bruikbare energie nu omgezet in onbruikbare energie.
Deze onbruikbare energie wordt gemeten met iets dat “entropie” heet, een barometer voor het meten van willekeurigheid of wanorde in een systeem.
Illustratie van entropie als toename van wanorde.
Het heelal is als een kamer gevuld met kleren die ongeorganiseerd rondslingeren. De entropie van dit systeem neemt toe naarmate meer en meer kleren worden gebruikt en weggegooid, waardoor de rommel toeneemt, tenzij de bewoner moeite doet om ze op te rapen en te ordenen, waardoor deze wanorde afneemt.
Als je het heelal als één systeem beschouwt, is er niets in zijn omgeving om energie aan te ontlenen, dus met al zijn energie omgezet in onbruikbare energie, is alles wat achterblijft een koude, donkere plaats. Dit wordt de hittedood genoemd en is een van de manieren waarop het heelal zou kunnen eindigen. Een begrensd systeem zoals ons Heelal bezit eindige energiebronnen, zoals zijn heldere sterren, die eeuwig zullen branden voordat ze zich overgeven aan de wrede wetten van de natuur.

Wat is de Derde Wet van de Thermodynamica?
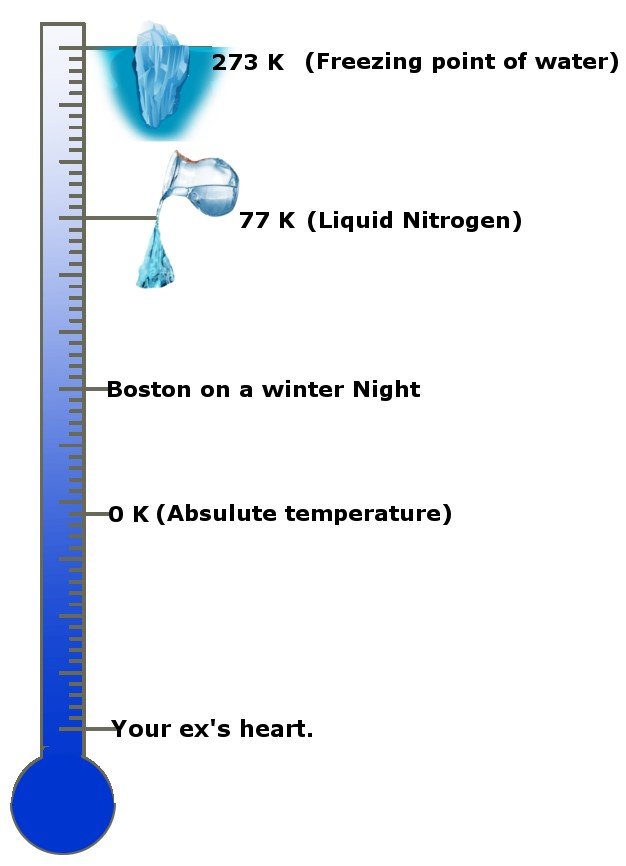
De derde wet van de thermodynamica voorspelt de eigenschappen van een systeem en het gedrag van entropie in een unieke omgeving die bekend staat als de absolute temperatuur. De absolute temperatuur is de laagste temperatuur die bekend is en stelt een ondergrens aan het temperatuurbereik van het heelal.
Hoe cool is dat! Nee, serieus, hoe koud is het? De absolute temperatuur is 0 Kelvin, de standaard eenheid van temperatuur of -273.15 graden Celsius! Absolute temperatuur wordt in sommige kringen en landen ook wel het absolute nulpunt genoemd. Deze schaal geeft je een idee.
De derde wet stelt dat als de temperatuur van een systeem het absolute nulpunt nadert, de entropie constant wordt, of de verandering in entropie nul is.

De stelling wordt weergegeven door deze vergelijking, waarin T de temperatuur is en delta S de verandering in de entropie van het systeem. De aanduiding “neigt naar nul”, weergegeven door een pijl die naar nul wijst, impliceert dat wanneer de temperatuur tot een infinitesimale waarde daalt, het systeem een constante entropie bereikt door energie aan de omgeving te onttrekken, maar zoals de eerste wet voorschrijft, zal een deel van deze energie aan de inwendige energie van het systeem worden toegevoegd, waardoor een constante entropie-toestand wordt ontkend.
Belang van de derde wet van de thermodynamica
De derde wet is zelden van toepassing op ons dagelijks leven en regelt de dynamica van voorwerpen bij de laagst bekende temperaturen. Zij definieert wat men noemt een “volmaakt kristal”, waarvan de atomen op hun plaats zijn vastgelijmd. Het volmaakte kristal bezit dus absoluut geen entropie, hetgeen alleen mogelijk is bij de absolute temperatuur.
Het begrip entropie is ook populair geweest in sommige theorieën die het continue verloop van de tijd objectief definiëren, zoals de lineaire toename van de entropie van het heelal.
In principe zullen bij 0 Kelvin de entropieveranderingen voor reacties betreffende de vorming van materie nul zijn, hoewel praktisch alle materie een zekere hoeveelheid entropie vertoont, als gevolg van de aanwezigheid van de geringste hoeveelheid warmte. Het koudste dat we hebben gemeten is 3 K, in de verre diepten van het heelal, voorbij sterren en sterrenstelsels.
Met andere woorden, geniet van de zomer zolang hij duurt!
Wat is de eerste hoofdwet van de thermodynamica?
Wat is de tweede hoofdwet van de thermodynamica?
Wat is de tweede hoofdwet van de thermodynamica?
